
| A. | pH值为1的溶液 Fe3+、NH4+、Cl-、SO42- | |
| B. | 滴加石蕊试液显红色的溶液 Fe2+、Na+、Mg2+、NO3- | |
| C. | 水电离出来的c(H+)=10-13 mol/L的溶液 K+、HCO3-、Br-、Ba2+ | |
| D. | 所含溶质为Na2SO4的溶液 K+、CO32-、NO3-、Al3+ |
分析 A.pH值为1的溶液,显酸性;
B.滴加石蕊试液显红色的溶液,显酸性;
C.水电离出来的c(H+)=10-13 mol/L的溶液,为酸或碱溶液;
D.离子之间相互促进水解.
解答 解:A.pH值为1的溶液,显酸性,该组离子之间不反应,可大量共存,故A正确;
B.滴加石蕊试液显红色的溶液,显酸性,Fe2+、H+、NO3-发生氧化还原反应,不能共存,故B错误;
C.水电离出来的c(H+)=10-13 mol/L的溶液,为酸或碱溶液,酸、碱溶液中均不能大量存在HCO3-,故C错误;
D.CO32-、Al3+相互促进水解,不能大量共存,故D错误;
故选A.
点评 本题考查离子的共存,为高频考点,把握习题中的信息及常见离子之间的反应为解答的关键,侧重复分解反应、氧化还原反应、水解反应的离子共存考查,综合性较强,题目难度不大.


科目:高中化学 来源: 题型:解答题
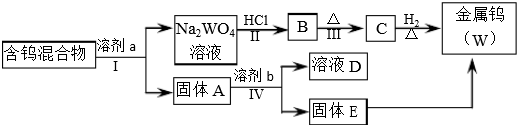
| 溶剂 | 煮沸时间(min) | W2O5(%) | WO3(%) | WO2 | 金属钨 |
| ①100g/L NaOH ②300g/LNa2CO3 ③50g/L Na2CO3 ④饱和Na2C2O4 ⑤饱和Na2C2O4(在CO2气氛下浸取) | 25 7 30 60 120 | 72.3 76.4 100 4.2 <0.5 | 100 100 100 100 100 | 未检出 | 未检出 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 A~D是原子序数在20以内的元素,其性质或结构信息如下表
A~D是原子序数在20以内的元素,其性质或结构信息如下表| 元素 | A | B | C | D | E |
| 性质或 结构 信息 | 其原子核内只有1个质子 | 其单质在空气中体积含量最多 | 地壳中含量最多的金属元素 | 其单质和化合物的焰色反应均为黄色 | 单质在常温、常压下是黄绿色气体 |
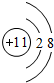 ,B原子的电子式:
,B原子的电子式: ,E离子的电子式:
,E离子的电子式: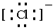 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
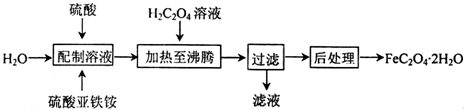

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 标准状况下,1.12LCCl4含有Cl原子数目为0.4NA | |
| B. | 标准状况下,2.24L氯气中含有的电子总数为3.4mol | |
| C. | 常温常压下,4.4gCO2与N2O混合气体中含有的原子总数为0.3NA | |
| D. | 39gNa2O2与足量H2O反应,转移电子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用食醋清洗热水瓶胆内壁附着的水垢(CaCO3) | |
| B. | 从海水中提取物质都必须通过化学反应才能实现 | |
| C. | 为了增加食物的营养成分,可以大量使用食品添加剂 | |
| D. | 高纯度的硅单质用于制作光导纤维 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com