
甲、乙、丙、丁是原子序数依次增大的四种短周期元素,A、B、C、D、E是由其中的两种或三种元素组成的化合物,F是由丙元素形成的单质。已知:A+B=D+F,A+C=E+F; 0.1mol•L-1D溶液的pH为13(25℃).下列说法正确的是
A.原子半径:丁>丙>乙>甲
B.1mol A与足量B完全反应共转移了2mol电子
C.丙元素在周期表中的位置为第二周期第ⅣA族
D.由甲、乙、丙、丁四种短周期元素组成的盐,其水溶液既有呈酸性的,也有呈碱性的
科目:高中化学 来源:2015-2016学年安徽省高二上期中测试化学试卷(解析版) 题型:选择题
在水溶液中存在反应:Ag++Fe2+ Ag(s)+Fe3+ ΔH<0,达到平衡后,为使平衡体系中析出更多的银,可采取的措施是
Ag(s)+Fe3+ ΔH<0,达到平衡后,为使平衡体系中析出更多的银,可采取的措施是
A.升高温度 B.加水稀释 C.增大Fe2+的浓度 D.常温下加压
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山东寿光现代中学高二上12月月考化学卷(解析版) 题型:选择题
常温下向10mLpH=3的醋酸溶液中加入水稀释后,下列说法正确的是
A.溶液中导电粒子的数目增加,导电性增强
B.醋酸的电离程度增大,[H+]减小
C.再加入10mL pH=11 NaOH溶液,混合液pH=7
D.溶液中由水电离出的[H+]=1×10-11mol•L-1
查看答案和解析>>
科目:高中化学 来源:2015-2016学年西藏日喀则中学高二上12月月考化学试卷(解析版) 题型:实验题
实验室常利用甲醛法测定(NH4)2SO4样品中氮的质量分数,其反应原理为:4NH4++6HCHO═3H++6H2O+(CH2)6N4H+[滴定时,1mol (CH2)6N4H+与1mol H+相当],然后用NaOH标准溶液滴定反应生成的酸.某兴趣小组用甲醛法进行了如下实验:
步骤I:称取样品1.500g.
步骤Ⅱ:将样品溶解后,完全转移到250mL容量瓶中,定容,充分摇匀.
步骤Ⅲ:移取25.00mL样品溶液于250mL锥形瓶中,加入10mL 20%的中性甲醛溶液,摇匀、静置5min后,加入1~2滴酚酞试液,用NaOH标准溶液滴定至终点.按上述操作方法再重复2次.
(1)根据步骤Ⅲ填空:
①碱式滴定管用蒸馏水洗涤后,直接加入NaOH标准溶液进行滴定,则测得样品中氮的质量分数_________(填“偏高”、“偏低”或“无影响”);
②锥形瓶用蒸馏水洗涤后,水未倒尽,则滴定时用去NaOH标准溶液的体积_________(填“偏高”、“偏低”或“无影响”);
③滴定时边滴边摇动锥形瓶,眼睛应观察_________;
A.滴定管内液面的变化 B.锥形瓶内溶液颜色的变化
④滴定达到终点时,酚酞指示剂由_________色;
(2)滴定结果如下表所示:
滴定次数 | 待测溶液的体积/mL | 标准溶液的体积 | |
滴定前刻度/mL | 滴定后刻度/mL | ||
1 | 25.00 | 1.02 | 21.03 |
2 | 25.00 | 2.00 | 21.99 |
3 | 25.00 | 0.20 | 20.20 |
若NaOH标准溶液的浓度为0.1010mol•L-1,则该样品中氮的质量分数为_________。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年西藏日喀则中学高二上12月月考化学试卷(解析版) 题型:选择题
将ag块状碳酸钙跟足量盐酸反应,反应损失的质量随时间的变化曲线如下图的实线所示。在相同条件下,将bg(a>b)粉末状碳酸钙与同浓度盐酸反应,则相应的曲线(图中虚线所示)正确的是( )
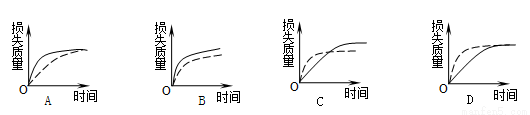
查看答案和解析>>
科目:高中化学 来源:2016届湖南省长沙市高三上学期月考化学试卷(解析版) 题型:选择题
下列实验操作中,仪器一定需要插入液面以下的
①制备Fe(OH)2时将NaOH溶液滴入FeSO4溶液中所用的胶头滴管
②制备氢气的简易装置中的长颈漏斗
③分馏石油时控制温度所用的温度计
④用乙醇制备乙烯时所用的温度计
⑤向BaCl2溶液中滴加稀硫酸所用的胶头滴管
A.③⑤ B.②⑤ C.①②④ D.①②③④⑤
查看答案和解析>>
科目:高中化学 来源:2016届江苏省高三上学期期中测试化学试卷(解析版) 题型:选择题
下列有关物质应用的说法正确的是
A.碳酸钠溶液显碱性,可用热的纯碱溶液除去金属器件表面油污
B.自来水厂可用明矾对水进行消毒杀菌
C.常温下,浓硝酸不跟铁发生化学反应,可用铁制容器盛装浓硝酸
D.MgO、Al2O3熔点高,可用于制作耐火材料
查看答案和解析>>
科目:高中化学 来源:2016届云南师范大学附属中学高三上高考适应性月考化学试卷(解析版) 题型:填空题
[化学—选修2:化学与技术]
煤炭被人们誉为黑色的“金子”,它是人类使用的主要能源之一。为了提高煤的利用率,减少有害气体的排放,人们采取了各式各样的方法。
(1)煤的气化和液化可能提高煤的利用率。煤的气化技术的主要产物是___________。煤的液化技术又分为直接液化和间接氧化.将煤隔绝空气加强热得到焦炉气、煤焦油及焦炭等产品的技术称为___________。
(2)煤在燃烧前、后及燃烧过程中均可采取措施减少有害气体的排放.
①在燃烧前,可以采用微生物脱硫技术.原理如下:

上述过程中Fe2+的作用为________________。写出Fe2+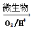 Fe3+的离子方程式________________。
Fe3+的离子方程式________________。
②煤在燃烧时,进行脱硫处理,常采用________燃烧技术,在把煤和脱硫剂加入锅炉燃烧室,使煤与空气在流化过程中充分混合、燃烧,起到固硫作用.常用脱硫剂的主要化学成分为_______(填化学式)。
③煤在燃烧后,烟气净化常采用除尘技术和脱硫、脱硝技术.湿法脱硫、脱硝技术中将烟气通入_________设备,用石灰水淋洗。
查看答案和解析>>
科目:高中化学 来源:2016届辽宁省高三上学期期中测试化学试卷(解析版) 题型:选择题
下列说法正确的是( )
A.根据反应Cu+H2SO4 CuSO4+H2↑可推出Cu的还原性比H2的强
CuSO4+H2↑可推出Cu的还原性比H2的强
B.电解含Pb(NO3)2和Cu(NO3)2的溶液,阴极上阳离子得电子次顺依次是
Cu2+、H+、Pb2+
C.含amolNa2S的溶液最多能吸收2.5amol的二氧化硫气体
D.因Cl2的氧化性强于I2的氧化性,所以置换反应I2+2NaClO3===2NaIO3+Cl2不能发生
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com