
【题目】二氧化铈(CeO2)是一种重要的稀土氧化物。平板电视显示屏生产过程中产生大量的废玻 璃粉末(含SiO2、Fe2O3、CeO2等物质)。某课题小组以此粉末为原料,设计资源回收的工艺流程如下: 
(1)写出第①步反应的离子方程式。
(2)洗涤滤渣B的目的是为了除去(填离子符号),检验该离子是否洗净的方法是。
(3)写出第③步反应的化学方程式。
(4)制备绿矾(FeSO4·7H2O)时,向Fe2(SO4)3溶液中加入过量铁屑,充分反应后,经过滤得到FeSO4溶液,再经、、过滤、洗涤、干燥等操作步骤得到绿矾。
(5)取上述流程中得到的Ce(OH)4产品(质量分数为86%)1.000g,加硫酸溶解后,用0.1000mol/L FeSO4溶液滴定至终点(铈被还原成Ce3+),则需准确滴加标准溶液的体积为mL。
【答案】
(1)SiO2+2OH-=SiO+H2O
(2)Fe3+;取最后一次洗涤液少许,加入KSCN溶液,若不出现红色则已洗净,若出现红色则未洗净
(3)2CeO2+ H2O2 +3H2SO4 = Ce2(SO4)3 + O2↑+ 4H2O
(4)蒸发浓缩;冷却结晶
(5)43.14
【解析】解:(1)根据废玻璃粉末的成分(含SiO2、Fe2O3、CeO2等物质),可知能与氢氧化钠反应的是二氧化硅.其离子方程式为SiO2+2OH-═SiO32-+H2O,
所以答案是:SiO2+2OH-═SiO32-+H2O;
(2)经分析滤渣A的成分是Fe2O3、CeO2;第②步反应Fe2O3与稀硫酸作用生成Fe2(SO4)3 , 洗涤滤渣B的目的显然是为了除去 Fe3+ , 检验铁离子是否洗净的方法是取最后一次洗涤液,加入KSCN溶液,若不出现红色,则已洗净,否则未洗净,
所以答案是:Fe3+;取最后一次洗涤液,加入KSCN溶液,若不出现红色,则已洗净,否则未洗净;
(3)第③步反应CeO2与H2O2和稀H2SO4反应生成Ce3+ , Ce元素由+4价变为+3价,被还原;则H2O2应被氧化生成O2 , 然后配平得出第③步反应的化学方程式 2CeO2+H2O2+3H2SO4═2Ce2(SO4)3+O2↑+4H2O;
所以答案是:2CeO2+H2O2+3H2SO4═Ce2(SO4)3+O2↑+4H2O;
(4)绿矾(FeSO47H2O)是结晶水合物,固体加热易分解;故由FeSO4溶液制备绿矾(FeSO47H2O)时,应经蒸发浓缩、冷却结晶、过滤、洗涤、干燥等操作步骤得到,
所以答案是:蒸发浓缩;冷却结晶;
(5)由已知条件:取上述流程中得到的Ce(OH)4产品(质量分数为86%)1.000g,加硫酸溶解后得Ce4+ , 用0.1000mol/LFeSO4溶液滴定至终点,铈被还原成Ce3+ , 则Fe2+被氧化为Fe3+ , 反应关系式为:Ce(OH)4~Ce3+~e-~Fe2+~Fe3+ , 则n(Ce(OH)4)=n(FeSO4)=1.000g×86%÷208g/mol=0.004314mol,滴加标准溶液的体积V=![]() =0.04314L=43.14mL,
=0.04314L=43.14mL,
所以答案是:43.14.


科目:高中化学 来源: 题型:
【题目】某化合物6.4g在O2中完全燃烧,只生成8.8g CO2和7.2g H2O.下列说法正确的是( )
A.该化合物仅含碳、氢两种元素
B.该化合物中碳、氢原子个数比为1:2
C.无法确定该化合物是否含有氧元素
D.该化合物中一定含有氧元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有Al、CuO、Fe2O3组成的混合物共10.0g,放入250mL某浓度的硫酸溶液中,混合物完全溶解,当再加入125mL 2.00mol/L的NaOH溶液时,得到沉淀物质的量最多.上述硫酸溶液的浓度为( )
A.0.500 mol/L
B.1.00 mol/L
C.2.00 mol/L
D.3.00 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:H2(g)+F2(g)=2HF(g)△H=﹣270kJ/mol,下列说法正确的是( )
A.在相同条件下,1mol H2与1mol F2的能量总和大于2mol HF气体的能量
B.1mol H2与1mol F2反应生成2mol液态HF放出的热量小于270kJ
C.该反应的逆反应是放热反应
D.该反应过程的能量变化可用如图来表示
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将14g铜银合金与足量某浓度的硝酸反应,使放出的气体与1.12L(标准状况)氧气混合恰好被水全部吸收生成硝酸,则合金中铜的质量为( )
A.3.2g
B.4.43g
C.10.8g
D.12.4g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水的综合利用包括很多方面,下图是从海水中通过一系列工艺流程提取产品的流程图。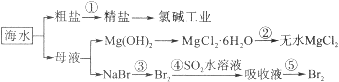
海水中主要含有Na+、K+、Mg2+、Ca2+、Cl-、Br-、SO42-、HCO3-等离子。
已知:MgCl2·6H2O受热生成Mg(OH)Cl和HCl气体等。回答下列问题:
(1)海水pH约为8的原因主要是天然海水含上述离子中的。
(2)除去粗盐溶液中的杂质(Mg2+、SO42-、Ca2+),加入药品的顺序可以为。
①NaOH溶液 ②BaCl2溶液 ③过滤后加盐酸 ④Na2CO3溶液
(3)过程②中由MgCl2·6H2O制得无水MgCl2 , 应如何操作。
(4)从能量角度来看,氯碱工业中的电解饱和食盐水是一个将转化为的过程。采用石墨阳极,不锈钢阴极电解熔融的氯化镁,发生反应的化学方程式为;电解时,若有少量水存在会造成产品镁的消耗,写出有关反应的化学方程式。
(5)从第③步到第④步的目的是。采用“空气吹出法”从浓海水中吹出Br2 , 并用SO2吸收。主要反应的化学方程式为。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】决定物质性质的重要因素是物质结构。请回答下列问题。
(1)已知A和B为第三周期元素,其原子的第一至第四电离能如下表所示:
电离能/kJ·mol-1 | I1 | I2 | I3 | I4 |
A | 578 | 1817 | 2745 | 11578 |
B | 738 | 1451 | 7733 | 10540 |
A通常显价,B元素的核外电子排布式为。
(2)波长为300nm紫外光的光子所具有的能量约为399 kJ·mol-1。根据下表有关蛋白质分子中重要化学键的信息,说明人体长时间照射紫外光后皮肤易受伤害的原因是。组成蛋白质的最简单的氨基酸中的碳原子杂化类型是。
共价键 | C-C | C-N | C-S |
键能/ kJ·mol-1 | 347 | 305 | 259 |
(3)实验证明:KCl、MgO、CaO、TiN这4种晶体的结构
与NaCl晶体结构相似(如下图所示),已知3种离子晶体的晶格能数据如下表: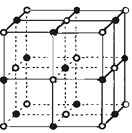
离子晶体 | NaCl | KCl | CaO |
晶格能/kJ·mol-1 | 786 | 715 | 3401 |
则该4种离子晶体(不包括NaCl)熔点从高到低的顺序是。其中MgO晶体中一个Mg2+周围和它最邻近且等距离的Mg2+有个。
(4)金属阳离子含未成对电子越多,则磁性越大,磁记录性能越好。离子型氧化物V2O5和CrO2中,适合作录音带磁粉原料的是。
(5)某配合物的分子结构如下图所示,其分子内不含有(填序号)。
A.离子键
B.极性键
C.金属键
D.配位键
E.氢键
F.非极性键
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com