
| A、1S22S22P2 |
| B、1S22S22P63S23P6 |
| C、1S22S22P5 |
| D、1S22S22P63S23P1 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
+ 4 |
2- 4 |
- 3 |
- 4 |
A、肯定有Al3+、Mg2+、Cl-,可能有NH
| ||||||||
B、肯定有Al3+、K+、Cl-,肯定没有MnO
| ||||||||
C、肯定有Al3+、Cl-,一定没有HCO
| ||||||||
| D、该溶液可能显弱酸性,也可能显中性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
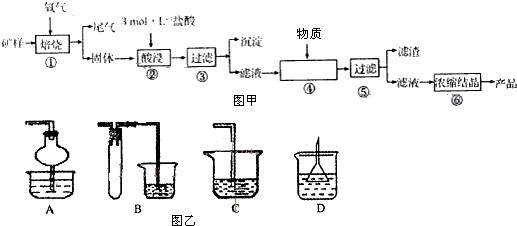
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 实验内容 | 结论 |
| A | 某气体的水溶液能使红色石蕊试纸变蓝 | 该气体一定是NH3 |
| B | 某气体能使紫色的酸性高锰酸钾溶液褪成无色 | 该气体一定是SO2 |
| C | 某物质的水溶液中加入盐酸产生能使澄清石灰水变浑浊的无色气体 | 该溶液一定含有CO32- |
| D | 某物质的水溶液中加入BaCl2溶液,产生白色沉淀,再加入稀硝酸,沉淀不溶解 | 该溶液中至少含有SO42-、SO32-中的一种 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、反应后溶液pH下降 |
| B、通常用盐酸酸化的高锰酸钾溶液 |
| C、方框中粒子为NO2 |
| D、当生成1 mol Mn2+ 需消耗2.5 mol NO2- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、若向该溶液中加入足量的NaOH溶液,充分反应后过滤、洗涤、灼烧,最终所得固体质量为72g |
| B、若向该溶液中加入过量的稀H2SO4,产生的气体遇空气能变成红棕色 |
| C、若向该溶液中加入过量的稀H2SO4和KSCN溶液,溶液不显血红色 |
| D、该溶液中所含的离子是:Fe2+、Ba2+、SO42-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在CCl4、PCl5、CS2分子中所有原子都满足最外层为8个电子稳定结构 |
| B、三氯化铁常温下为固体,熔点282℃,沸点315℃,在300℃以上易升华,易溶于水,也易溶于乙醚、丙酮等有机溶剂,因此三氯化铁晶体是分子晶体 |
| C、Na3N与NaH均为离子化合物,都能与水反应放出气体,且与水反应所得溶液均能使酚酞试液变红 |
| D、SO2、H2O都是由极性键形成的非极性分子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com