
分析 (1)根据离子反应方程式的书写规则书写该离子反应方程式;
(2)在反应中,化合价升高的氯元素部分表现了盐酸的还原性,根据化合价的升降和电子转移之间的关系来回答.
解答 解:(1)MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O反应改写为离子方程式时氧化物、单质、水、难溶物质要写成化学式的形式,则其离子方程式为:4H++2Cl-+MnO2$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O;
故答案为:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++2H2O+Cl2↑;
(2)反应参加反应的4molHCl中,被氧化的HCl是2mol,未被氧化的HCl的物质的量是2mol,所以之比被氧化的HCl和未被氧化的HCl的物质的量之比为1:1,有2mol HCl被氧化,转移电子的数目是2mol,所以有0.2mol HCl被氧化,转移电子的数目是0.2NA,故答案为:1:1;0.2NA.
点评 本题考查了氧化还原反应,侧重于氧化还原反应概念及电子转移的考查,题目难度不大,注意从化合价的角度分析.


科目:高中化学 来源: 题型:选择题
| A. | 胶体区别于其它分散系的本质特征是具有丁达尔现象 | |
| B. | 将直径等于2.5微米的颗粒物分散于水即成为胶体 | |
| C. | 雾具有丁达尔现象 | |
| D. | 增加使用汽车,提高交通效率可缓解雾霾天气的产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 148 g•mol-1 | B. | 24 g•mol-1 | C. | 74 g•mol-1 | D. | 40 g•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
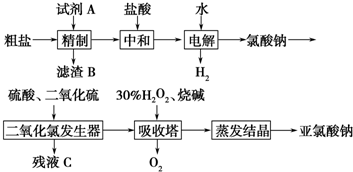
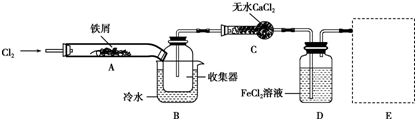
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 室温下体积为10L、pH=13的NaOH溶液中含有OH-的数目为NA | |
| B. | 常温常压下,17g氨气中含有氢原子的数目为NA | |
| C. | PH=1的醋酸溶液中,醋酸分子的个数为NA | |
| D. | 体积为1L、物质的量浓度为1mol•L-1的Na2CO3溶液中含有NA个CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2 | B. | NaCl | C. | K2CO3 | D. | Al |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稀硫酸与氢氧化钡溶液恰好中和:Ba2++OH-+H++SO42-═BaSO4↓+H2O | |
| B. | 测得0.1 mol/L氨水中c(OH-)为10-3 mol•L-1:NH3•H2O?NH4++OH- | |
| C. | 在偏铝酸钠溶液中通入过量CO2出现白色沉淀:2AlO2-+CO2+3H2O═2Al(OH)3↓+CO32- | |
| D. | 碳酸氢钠溶液与过量石灰水混合出现白色沉淀:2HCO3-+Ca2++2OH-═CaCO3↓+CO32-+2H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com