
【题目】分子式为C7H16O的饱和一元醇的同分异构体有多种,在下列该醇的同分异构体中, 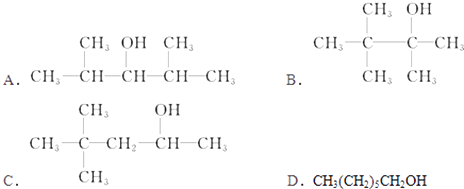
(1)可以发生消去反应,生成两种单烯烃的是(用符号表示)
(2)可以发生催化氧化反应生成醛的是(用符号表示)
(3)不能发生催化氧化反应的是(用符号表示)
(4)能被催化氧化为酮的有种.
(5)能使酸性高锰酸钾溶液褪色的有种.
【答案】
(1)C
(2)D
(3)B
(4)2
(5)3
【解析】解:(1)有机物可以发生消去反应,生成两种单烯烃,说明该醇中与﹣OH相连的C的两个邻位C上有H,且不具有对称结构,满足条件的为C,所以答案是:C(2)可以发生催化氧化生成醛,说明分子中与﹣OH相连C上有2个H,满足条件的为:D.CH3(CH2)5CH2OH,所以答案是:D;(3)不能发生催化氧化,说明连接羟基的C原子数不含H原子,满足条件的为:B,所以答案是:B;(4)能被催化氧化为酮,说明连接羟基的C原子数含有1个H原子,满足条件的为:A、C,总共有2种,所以答案是:2;(5)能使酸性KMnO4溶液褪色,说明连接羟基的碳原子上含有H,满足条件的为:A. ![]() 、C.
、C. 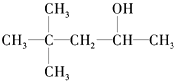 、D.CH3(CH2)5CH2OH,总共有3种,所以答案是:3.
、D.CH3(CH2)5CH2OH,总共有3种,所以答案是:3.


科目:高中化学 来源: 题型:
【题目】正丁醚常用作有机反应的溶剂.实验室制备正丁醚的反应和主要实验装置如下:2CH3CH2CH2CH2OH ![]() (CH3CH2CH2CH2)2O+H2O
(CH3CH2CH2CH2)2O+H2O
反应物和产物的相关数据如下
相对分子质量 | 沸点/℃ | 密度/(gcm﹣3) | 水中溶解性 | |
正丁醇 | 74 | 117.2 | 0.8109 | 微溶 |
正丁醚 | 130 | 142.0 | 0.7704 | 几乎不溶 |
合成反应:
①将6mL浓硫酸和37g正丁醇,按一定顺序添加到A中,并加几粒沸石.
②加热A中反应液,迅速升温至135℃,维持反应一段时间.分离提纯.
③待A中液体冷却后将其缓慢倒人盛有70mL水的分液谝斗中,振摇后静置,分液得粗产物.
④粗产物依次用40mL水、20mL NaOH溶液和40mL水洗涤,分液后加入约3g无水氯化钙颗粒,静置一段时间后弃去氯化钙.
⑤将上述处理过的粗产物进行蒸馏,收集馏分,得纯净正丁醚11g.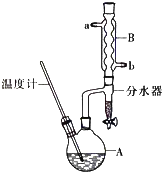
请回答:
(1)步骤①中浓硫酸和正丁醇的添加顺序为 .
(2)加热A前,需先从(填“a”或“b”)口向B中通入水.
(3)步骤③的目的是初步洗去 , 振摇后静置,粗产物应从分液漏斗的(填“上”或“下”)口分离出.
(4)步骤③巾最后一次水洗的目的为 .
(5)步骤⑤中,加热蒸馏时应收集(填选项字母)左右的馏分.a.100℃b.117℃c. 135℃d.142℃
(6)反应过程中会观察到分水器中收集到液体物质,且分为上下两层,随着反应的进行,分水器中液体逐渐增多至充满时,上层液体会从左侧支管自动流回A.分水器中上层液体的主要成分为 , 下层液体的主要成分为 .
(7)本实验中,正丁醚的产率为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.按照系统命名法,烃分子  的名称为2,3﹣二甲基﹣3﹣乙基戊烷
的名称为2,3﹣二甲基﹣3﹣乙基戊烷
B.鸡蛋白、大豆蛋白等蛋白质可溶于水,在这些蛋白质溶液中加入(NH4)2SO4或Na2SO4的浓溶液,可使蛋白质的溶解度降低而析出
C.![]() 可发生加成反应、取代反应、氧化反应
可发生加成反应、取代反应、氧化反应
D.有机物 ![]() (俗称“一滴香”)的一种含苯环的同分异构体能发生银镜反应
(俗称“一滴香”)的一种含苯环的同分异构体能发生银镜反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下说法不正确的是( )
A.1mol乙醇可以与足量金属钠反应,生成0.5molH2 , 能证明乙醇分子有一个H原子与其余的H原子不同
B.下列反应可证明苯环受甲基的影响,甲苯易被酸性高锰酸钾氧化 ![]()
C.下列反应可证明由于羟基对苯环的影响,导致苯酚的取代比苯容易 
D.苯不能使溴的四氯化碳溶液褪色可以说明苯分子中没有与乙烯分子中类似的碳碳双键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,属非氧化还原反应的是
A. 3CuS+8HNO3==3Cu(NO3)2+2NO↑+3S↓+4H2O
B. 3Cl2+6KOH == 5KCl+KClO3+3H2O
C. 3H2O2+2KCrO2+2KOH==2K2CrO4+4H2O
D. 3CCl4+K2Cr2O7==2CrO2Cl2+3COCl2+2KCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.按照系统命名法,烃分子  的名称为2,3﹣二甲基﹣3﹣乙基戊烷
的名称为2,3﹣二甲基﹣3﹣乙基戊烷
B.鸡蛋白、大豆蛋白等蛋白质可溶于水,在这些蛋白质溶液中加入(NH4)2SO4或Na2SO4的浓溶液,可使蛋白质的溶解度降低而析出
C.![]() 可发生加成反应、取代反应、氧化反应
可发生加成反应、取代反应、氧化反应
D.有机物 ![]() (俗称“一滴香”)的一种含苯环的同分异构体能发生银镜反应
(俗称“一滴香”)的一种含苯环的同分异构体能发生银镜反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在日常生活中,我们经常看到铁制品生锈、铝制品表面出现白斑等众多的金属腐蚀现象.可以通过下列装置所示实验进行探究.下列说法正确的是( ) 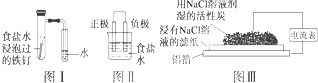
A.按图Ⅰ装置实验,为了更快更清晰地观察到液柱上升,可采用下列方法:用酒精灯加热具支试管
B.图Ⅱ是图Ⅰ所示装置的原理示意图,图Ⅱ的正极材料是铁
C.铝制品表面出现白斑可以通过图Ⅲ装置进行探究,Cl﹣由活性炭区向铝箔表面区迁移,并发生电极反应:2Cl﹣﹣2e﹣═Cl2↑
D.图Ⅲ装置的总反应为4Al+3O2+6H2O═4Al(OH)3 , 生成的Al(OH)3进一步脱水形成白斑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据所学知识完成下面题目:
(1)铁钉在氯气中被锈蚀为棕黄色物质FeCl3 , 而在盐酸中生成浅绿色的FeCl2溶液.则在Cl2、Cl﹣、H+中,具有氧化性的是 , 其中氧化性强的是 .
(2)盐酸在不同的反应中,可以分别表现出酸性、氧化性和还原性.现有如下三个反应,请写出盐酸在三个反应中,分别表现什么性质:①NaOH+HCl═NaCl+H2O;
②2HCl ![]() H2↑+Cl2↑ .
H2↑+Cl2↑ .
③MnO2+4HCl(浓 ![]() MnCl2+Cl2↑+2H2O .
MnCl2+Cl2↑+2H2O .
(3)并用“双线桥法”标出反应③电子转移的方向和数目 .
(4)在某体系内有反应物和生成物5种物质:H2S、S、FeCl3、FeCl2、HCl.已知H2S为反应物,写出反应的化学方程式(不必配平) .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化镁在医药、建筑等行业应用广泛.硫酸镁还原热解制备高纯氧化镁是一种新的探索.以菱镁矿(主要成分为MgCO3 , 含少量FeCO3)为原料制备高纯氧化镁的实验流程如下: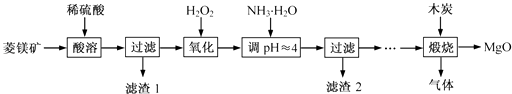
(1)MgCO3与稀硫酸反应的离子方程式为 .
(2)加入H2O2 氧化时,发生反应的化学方程式为 .
(3)滤渣2 的成分是(填化学式).
(4)煅烧过程存在以下反应:2MgSO4+C ![]() 2MgO+2SO2↑+CO2↑
2MgO+2SO2↑+CO2↑
MgSO4+C ![]() MgO+SO2↑+CO↑
MgO+SO2↑+CO↑
MgSO4+3C ![]() MgO+S↑+3CO↑
MgO+S↑+3CO↑
利用如图装置对煅烧产生的气体进行分步吸收或收集.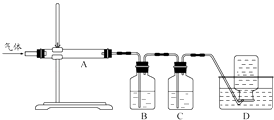
①D中收集的气体可以是(填化学式).
②B中盛放的溶液可以是(填字母).
a.NaOH 溶液 b.Na2CO3 溶液 c.稀硝酸 d.KMnO4溶液
③A中得到的淡黄色固体与热的NaOH溶液反应,产物中元素最高价态为+4,写出该反应的离子方程式: .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com