
ЁОЬтФПЁП(2018ЁЄЬьНђЪаЪЎЖўжиЕужабЇБЯвЕАрСЊПМ)вбжЊЃК25ЁцЪБH2C2O4ЕФpKa1=1.22ЃЌpKa2=4.19ЃЌCH3COOHЕФpK a=4.76ЃЌKДњБэЕчРыЦНКтГЃЪ§ЃЌpK = -1gKЁЃЯТСаЫЕЗЈе§ШЗЕФЪЧ
A. ХЈЖШОљЮЊ0.1molЁЄL-1NH4HC2O4КЭCH3COONH4ШмвКжаЃКc(NH4+)ЧАепаЁгкКѓеп
B. НЋ0.1molЁЄL-1ЕФK2C2O4ШмвКДг25ЁцЩ§ЮТжС35ЁцЃЌ![]() МѕаЁ
МѕаЁ
C. 0.1 molЁЄL-1K2C2O4ШмвКЕЮМгбЮЫсжСpH=1.22ЃКc(H+)-c(OH-)=c(Cl-)-3c(HC2O4-)
D. Яђ0.1 molЁЄL-1CH3COONaШмвКжаЕЮМгЩйСП0.1 molЁЄL-1H2C2O4ШмвКЃКCH3COO- + H2C2O4 = CH3COOH + HC2O4-
ЁОД№АИЁПC
ЁОНтЮіЁПгЩвбжЊЪ§ОнЗжЮіПЩЕУЃЌHC2O4-ЕФЫЎНтГЬЖШаЁгкCH3COO-ЕФЫЎНтГЬЖШЃЌ HC2O4-ЖдNH4+ЫЎНтЕФДйНјзїгУаЁгкCH3COO-ЃЌЙЪc(NH4+)ЧАепДѓгкКѓепЃЌAДэЮѓЃЛЫЎНтЙ§ГЬЮќШШЃЌвђДЫНЋ0.1molЁЄL-1ЕФK2C2O4ШмвКДг25ЁцЩ§ЮТжС35ЁцЃЌДйНјСЫK2C2O4ЫЎНтЃЌc(C2O42_)МѕаЁЃЌc(K+)ВЛБфЃЌЫљвд![]() діДѓЃЌBДэЮѓЃЛ0.1molЁЄL-1ЕФK2C2O4ШмвКЕЮМгбЮЫсжСpH=1.22ЃЌдђЩњГЩKClКЭH2C2O4ЃЌЧвc(H+)=10-1.22mol/LЃЌвбжЊ
діДѓЃЌBДэЮѓЃЛ0.1molЁЄL-1ЕФK2C2O4ШмвКЕЮМгбЮЫсжСpH=1.22ЃЌдђЩњГЩKClКЭH2C2O4ЃЌЧвc(H+)=10-1.22mol/LЃЌвбжЊ![]() ЃЌ
ЃЌ![]() ЃЌЫљвд
ЃЌЫљвд![]() ЃЌгЩжЪзгЪиКуПЩЕУc(H+)+ c(HC2O4-)+2c(H2C2O4)=c(Cl-)+3c(OH-)ЃЌЫљвд
ЃЌгЩжЪзгЪиКуПЩЕУc(H+)+ c(HC2O4-)+2c(H2C2O4)=c(Cl-)+3c(OH-)ЃЌЫљвд![]() ЃЌCе§ШЗЃЛИљОнЕчРыЦНКтГЃЪ§ПЩжЊЃКЫсадЃКH2C2O4> HC2O4-> CH3COOHЃЌвђДЫЯђ0.1 molЁЄL-1CH3COONaШмвКжаЕЮМгЩйСП0.1 molЁЄL-1H2C2O4ШмвКЃК2CH3COO- + H2C2O4 = 2CH3COOH + C2O42-ЃЛDДэЮѓЃЛе§ШЗбЁЯюCЁЃ
ЃЌCе§ШЗЃЛИљОнЕчРыЦНКтГЃЪ§ПЩжЊЃКЫсадЃКH2C2O4> HC2O4-> CH3COOHЃЌвђДЫЯђ0.1 molЁЄL-1CH3COONaШмвКжаЕЮМгЩйСП0.1 molЁЄL-1H2C2O4ШмвКЃК2CH3COO- + H2C2O4 = 2CH3COOH + C2O42-ЃЛDДэЮѓЃЛе§ШЗбЁЯюCЁЃ


 ПЊаФПьРжМйЦкзївЕЪюМйзївЕЮїАВГіАцЩчЯЕСаД№АИ
ПЊаФПьРжМйЦкзївЕЪюМйзївЕЮїАВГіАцЩчЯЕСаД№АИ
| ФъМЖ | ИпжаПЮГЬ | ФъМЖ | ГѕжаПЮГЬ |
| ИпвЛ | ИпвЛУтЗбПЮГЬЭЦМіЃЁ | ГѕвЛ | ГѕвЛУтЗбПЮГЬЭЦМіЃЁ |
| ИпЖў | ИпЖўУтЗбПЮГЬЭЦМіЃЁ | ГѕЖў | ГѕЖўУтЗбПЮГЬЭЦМіЃЁ |
| ИпШ§ | ИпШ§УтЗбПЮГЬЭЦМіЃЁ | ГѕШ§ | ГѕШ§УтЗбПЮГЬЭЦМіЃЁ |
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСаИїзщРызгФмдкШмвКжаДѓСПЙВДцЕФЪЧЃЈЁЁЁЁЃЉ
A.Na+ЁЂMg2+ЁЂClЉЁЂOHЉ
B.H+ЁЂCa2+ЁЂCO32ЉЁЂNO3Љ
C.Na+ЁЂHCO3ЉЁЂOHЉЁЂCa2+
D.Cu2+ЁЂK+ЁЂSO42ЉЁЂNO3Љ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЩшNAБэЪОАЂЗќМгЕТТоГЃЪ§ЕФжЕ,ЯТСаЫЕЗЈе§ШЗЕФЪЧ()
A. ЗжзгзмЪ§ЮЊNAЕФNO2КЭCO2ЕФЛьКЯЦјЬхжаКЌгаЕФбѕдзгЪ§ЮЊ2NA
B. 1mol NaClжаЫљКЌЕчзгзмЪ§ЮЊ20NA
C. 46g NO2КЭN2O4ЕФЛьКЯЦјЬхжаКЌгаЕФдзгзмЪ§ЮЊ4.5NA
D. ГЃЮТГЃбЙЯТ,22.4L CO2жаКЌгаЕФCO2ЗжзгЪ§ЮЊNA
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСаЗДгІНјааЗжРрЪБЃЌМШЪєгкбѕЛЏЛЙдЗДгІгжЪєгкжУЛЛЗДгІЕФЪЧ (ЁЁЁЁ)
A. CH4ЃЋ2O2![]() CO2ЃЋ2H2O B. 2KClO3
CO2ЃЋ2H2O B. 2KClO3![]() 2KClЃЋ3O2Ёќ
2KClЃЋ3O2Ёќ
C. SЃЋO2![]() SO2 D. 8NH3+3Cl2=6NH4Cl+N2Ёќ
SO2 D. 8NH3+3Cl2=6NH4Cl+N2Ёќ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСаЙигкЖўбѕЛЏСђЦјЬхаджЪЕФУшЪіжаЃЌВЛе§ШЗЕФЪЧЃЈ ЃЉ
A.ФмШмгкЫЎB.ПеЦјжаФмгыбѕЦјЗДгІЩњГЩШ§бѕЛЏСђ
C.ФмЪЙЦЗКьШмвКЭЪЩЋD.ФмгыNaOHШмвКЗДгІ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЕтЛЏФЦгУзїМззДЯйжзСіЗРжЮМСЁЂьюЬЕМСКЭРћФђМСЕШЁЃЪЕбщЪвгУNaOHЁЂЕЅжЪЕтКЭЫЎКЯыТ(N2H4ЁЄH2O)ЮЊдСЯПЩжЦБИЕтЛЏФЦЁЃ
зЪСЯЯдЪОЃКЫЎКЯыТгаЛЙдадЃЌФмЯћГ§ЫЎжаШмНтЕФбѕЦјЃЛNaIO3ЪЧвЛжжбѕЛЏМСЁЃ
ЛиД№ЯТСаЮЪЬтЃК
ЃЈ1ЃЉЫЎКЯыТЕФжЦБИ
гаЙиЗДгІдРэЮЊЃКNaClO + 2NH3 = N2H4ЁЄH2O + NaClЁЃ
ЂйгУЯТЭМзАжУжЦШЁЫЎКЯыТЃЌЦфСЌНгЫГађЮЊ_________(АДЦјСїЗНЯђЃЌгУаЁаДзжФИБэЪО)ЁЃ
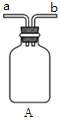
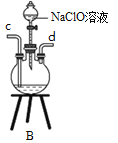
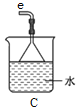
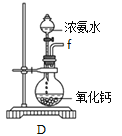
ЂкзАжУAЕФзїгУЪЧ_______ЁЃ
ЂлПЊЪМЪЕбщЪБЃЌЯШЯђбѕЛЏИЦжаЕЮМгХЈАБЫЎЃЌвЛЖЮЪБМфКѓдйЯђBЕФШ§ПкЩеЦПжаЕЮМгNaClOШмвКЁЃЕЮМгNaClOШмвКЪБВЛФмЙ§ПьЕФРэгЩ___________
ЃЈ2ЃЉЕтЛЏФЦЕФжЦБИ
i. ЯђШ§ПкЩеЦПжаМгШы8.4gNaOHМА30mLЫЎЃЌНСАшЁЂРфШДЃЌМгШы25.4gЕтЕЅжЪЃЌПЊЖЏДХСІНСАшЦїЃЌБЃГж60~70ЁцжСЗДгІГфЗжЃЛ
iiЃЎМЬајМгШыЩдЙ§СПЕФN2H4ЁЄH2O(ЫЎКЯыТ)ЃЌЛЙдNaIOКЭNaIO3ЃЌЕУNaIШмвКДжЦЗЃЌЭЌЪБЪЭЗХвЛжжПеЦјжаЕФЦјЬхЃЛ
iiiЃЎЯђЩЯЪіЗДгІвКжаМгШы1.0gЛюадЬПЃЌжѓЗаАыаЁЪБЃЌШЛКѓНЋШмвКгыЛюадЬПЗжРы;
ivЃЎНЋВНжшiiiЗжРыГіЕФШмвКеєЗЂХЈЫѕЁЂРфШДНсОЇЁЂЙ§ТЫЁЂЯДЕгЁЂИЩдяЃЌЕУВњЦЗ24.0gЁЃ
ЂмВНжшiЪЪвЫВЩгУЕФМгШШЗНЗЈЪЧ_________ЃЌ ИУВНжшЗДгІЭъШЋЕФЯжЯѓЪЧ_________ЁЃ
ВНжшiiжаIO3ЃВЮгыЗДгІЕФРызгЗНГЬЪНЮЊ________________________________ЁЃ
ЂнВНжшiiiЁАНЋШмвКгыЛюадЬПЗжРыЁБЕФЗНЗЈЪЧ_____________________________ЁЃ
ЂоБОДЮЪЕбщВњТЪЮЊ__________ЁЃЪЕбщЗЂЯжЃЌЫЎКЯыТЪЕМЪгУСПБШРэТлжЕЦЋИпЃЌПЩФмЕФдвђЪЧ________________________________________________ЁЃ
Ђп ФГЭЌбЇМьбщВњЦЗNaIжаЪЧЗёЛьгаNaIO3дгжЪЁЃШЁЩйСПЙЬЬхбљЦЗгкЪдЙмжаЃЌМгЫЎШмНтЃЌЕЮМгЩйСПЕэЗлвККѓдйЕЮМгЪЪСПЯЁСђЫсЃЌЦЌПЬКѓШмвКБфРЖЁЃЕУГіNaIжаКЌгаNaIO3дгжЪЁЃЧыЦРМлИУЪЕбщНсТлЕФКЯРэад___________________________ЃЈШєШЯЮЊКЯРэаДГіРызгЗНГЬЪНЃЌШєШЯЮЊВЛКЯРэЫЕУїРэгЩЃЉ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПФГПЦбааЁзщЙЋЫОПЊЗЂСЫLi-SO2Cl2ОќгУЕчГиЃЌЦфЪОвтЭМШчЯТЭМЫљЪОЃЌвбжЊЕчГизмЗДгІЮЊЃК2Li+ SO2Cl2= 2LiCl+SO2ЁќЁЃЯТСаа№ЪіжаДэЮѓЕФЪЧ
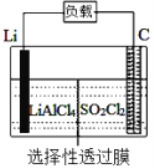
A. ЕчГиЙЄзїЪБИКМЋВФСЯЪЧLiЃЌЗЂЩњбѕЛЏЗДгІ
B. ЕчГиЙЄзїЪБЕчзгСїЯђЃКяЎЕчМЋЁњЕМЯпЁњИКдиЁњЬМАє
C. ЕчГиЙЄзїЪБЃЌЭтЕчТЗСїЙ§0.2 molЕчзгЃЌБъзМзДПіЯТЩњГЩ4.48 LЦјЬх
D. ЕчГиЙЄзїЙ§ГЬжаЃЌЪЏФЋЕчМЋЗДгІЪНЮЊSO2Cl2+2e-=2Cl-+SO2Ёќ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПШ§ТШбѕСз(POCl3)ПЩгУзїгаЛњКЯГЩЕФТШЛЏМСКЭДпЛЏМСЁЃ
вбжЊЃКЂйKSCN+AgNO3=AgSCNЁ§+KNO3ЃЛ
ЂкKsp(AgCl) > Ksp(AgSCN)ЃЛ
ЂлСзЫсвјПЩШмгкЯѕЫсЃЛ
ЂмPCl3КЭPOCl3ЕФЯрЙиаХЯЂШчЯТБэЃК
ЮяжЪ | ШлЕу/Ёц | ЗаЕу/Ёц | ЯрЖдЗжзгжЪСП | аджЪ |
PCl3 | -111.8 | 74.2 | 137.5 | ОљЮЊЮоЩЋвКЬхЃЌгіЫЎОљОчСвЫЎНтЃЌЩњГЩКЌбѕЫсКЭТШЛЏЧтЃЌСНепЛЅШмЁЃ |
POCl3 | 2.0 | 105.3 | 153.5 |
ЪЕбщЪвжЦШЁPOCl3ВЂВтЖЈВњЦЗДПЖШЕФЪЕбщЙ§ГЬШчЯТЃК
Ђё.жЦБИPOCl3ПЩгУбѕЦјбѕЛЏвКЬЌPCl3ЕФЗНЗЈЁЃЪЕбщзАжУЃЈМгШШМАМаГжзАжУЪЁТдЃЉШчЯТЃК
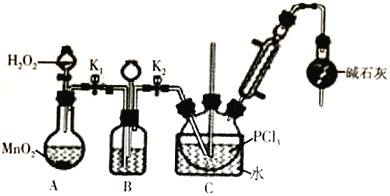
ЃЈ1ЃЉзАжУCжаЪЂзАPCl3ЕФвЧЦїУћГЦЮЊ_______________________ЃЛбѕЦјбѕЛЏPCl3ЕФЛЏбЇЗНГЬЪНЮЊ_______________________________ЁЃ
ЃЈ2ЃЉвЧЦїзщзАЭъГЩКѓЃЌМьВщзАжУBЦјУмадЕФЗНЗЈЪЧ_______________________________ЁЃ
ЃЈ3ЃЉзАжУBЕФзїгУга________________________________ЃЈЛиД№СНЕуЃЉЁЃ
ЃЈ4ЃЉзАжУCЕФЗДгІЮТЖШПижЦдк60-65ЁцжЎМфЃЌдвђЪЧ____________________________________ЁЃ
Ђђ.ВтЖЈВњЦЗжаPOCl3ДПЖШЕФЪЕбщВНжшЃК
ЂйЪЕбщЂёНсЪјКѓЃЌД§ЗДгІЦїжавКЬхРфШДЕНЪвЮТЃЌзМШЗГЦШЁ1.3300 gЕФPOCl3ДжВњЦЗЃЈдгжЪВЛКЌТШдЊЫиЃЉЃЌжУгкЪЂга50.00mLеєСѓЫЎЕФЩеБжавЁЖЏжСЭъШЋЫЎНтЃЌНЋЫЎНтвКХфГЩ100.00mLШмвКЃЛ
ЂкШЁ10.00mLШмвКгкзЖаЮЦПжаЃЌМгШы30.00mL0.1200molЁЄL-1AgNO3БъзМШмвКЃЛ
ЂлМгШыЩйСПЯѕЛљБНЃЌгУСІвЁЖЏЃЌОВжУЃЛ
ЂмМгШыжИЪОМСЃЌгУ0.1000 molЁЄL-1KSCNШмвКЕЮЖЈЙ§СПЕФAgNO3ШмвКЃЌЕНДяжеЕуЪБЙВгУШЅ12.00mLKSCNШмвКЁЃ
ЃЈ5ЃЉЕЮЖЈЙ§ГЬжабЁдёЕФжИЪОМСЮЊ___________ШмвКЁЃ
ЃЈ6ЃЉВНжшЂлЕФФПЕФЪЧ___________________________________________________ЁЃ
ЃЈ7ЃЉВтЕУВњЦЗжаPOCl3ЕФДПЖШЮЊ__________%ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПNaClбљЦЗжаКЌгаЩйСПЕФNa2SO4КЭNa2CO3ЃЌАДЯТСаСїГЬНјааОЛЛЏЁЃ
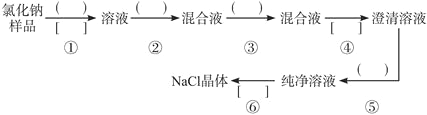
ЃЈ1ЃЉСїГЬЕкЂкЂлВНжагІЗжБ№ЪЙгУ________ЁЂ_________ЪдМСЃЌЕкЂоВНжагІНјаа_________Вйзї
ЃЈ2ЃЉаДГіЕкЂнВНЗЂЩњЗДгІЕФЛЏбЇЗНГЬЪНЃК______________________ЁЃ
ВщПДД№АИКЭНтЮі>>
АйЖШжТаХ - СЗЯАВсСаБэ - ЪдЬтСаБэ
КўББЪЁЛЅСЊЭјЮЅЗЈКЭВЛСМаХЯЂОйБЈЦНЬЈ | ЭјЩЯгаКІаХЯЂОйБЈзЈЧј | ЕчаХеЉЦОйБЈзЈЧј | ЩцРњЪЗащЮожївхгаКІаХЯЂОйБЈзЈЧј | ЩцЦѓЧжШЈОйБЈзЈЧј
ЮЅЗЈКЭВЛСМаХЯЂОйБЈЕчЛАЃК027-86699610 ОйБЈгЪЯфЃК58377363@163.com