
| A.①④⑤ | B.②③⑥⑦ | C.③⑥⑦⑧ | D.①②④ |
科目:高中化学 来源:不详 题型:填空题
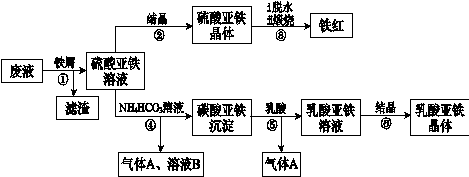
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
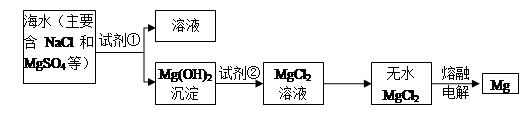
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.通入过量的空气 | B.液体燃料呈雾状喷出 |
| C.将氢气、氧气设计成燃料电池 | D.将煤粉粉碎 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.加大太阳能、水能、风能、地热能等能源开发力度,减少化石燃料的使用 |
| B.研制乙醇汽油技术,降低机动车辆尾气中有害气体排放 |
| C.生产、生活中,努力实现资源的循环利用 |
| D.利用高新技术,提高石油、煤、天然气产量,以满足工业生产快速发展的需求 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.向含有1 mol KAl(SO4)2的溶液中加入Ba(OH)2溶液至沉淀质量最大时,沉淀的总的物质的量为2mol |
| B.裂解、煤的汽化、石油减压分馏、甲苯制TNT等过程中都包含化学变化 |
| C.需要通电才可进行的有:电离、电解、电镀、电化学腐蚀 |
| D.乙醇和丙烯的物质的量均为1mol,完成燃烧消耗的氧气的质量相同 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.金属在地壳中的含量多少 | B.金属的熔沸点高低 |
| C.金属的活泼性强弱 | D.金属的导电性强弱 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
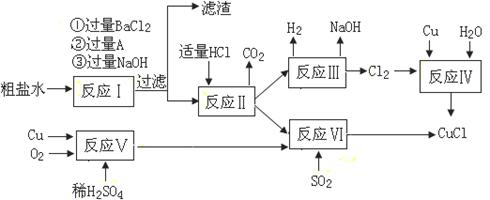
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.制石灰乳:CaO+H2O=Ca(OH)2 第3页(共6页) | |
| B.制Mg(OH)2:MgCl2+Ca(OH)2=Mg(OH)2↓+CaCl2 | C.制MgCl2:Mg(OH)2+2HCl=MgCl2+2H2O |
| D.制Mg,在MgCl2溶液中加Na:MgCl2+2Na=2NaCl+Mg |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com