
【题目】利用如图所示装置进行下列实验,能得出相应实验结论的是( )
选项 | ① | ② | ③ | 实验结论 |
|
A | 浓盐酸 | MnO2 | NaBr溶液 | 氧化性Cl2>Br2 | |
B | 浓氨水 | 碱石灰 | AgNO3溶液 | AgOH具有两性 | |
C | 浓硫酸 | Na2SO3 | FeCl3溶液 | SO2具有还原性 | |
D | 稀盐酸 | Na2CO3 | Na2SiO3溶液 | 非金属性:Cl>C>Si |
A.AB.BC.CD.D
 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案科目:高中化学 来源: 题型:
【题目】在一定温度下,将气体X和气体Y各0.16mol充入10L恒容密闭容器中,发生反应
X(g)+Y(g) ![]() 2Z(g) △H < 0,一段时间后达到平衡,反应过程中测定的数据如下表:
2Z(g) △H < 0,一段时间后达到平衡,反应过程中测定的数据如下表:
t/min | 2 | 4 | 7 | 9 |
n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
下列说法正确的是
A.反应前2min的平均速率ν(Z)=2.0×10-3mol·L-1·min-1
B.其他条件不变,降低温度,反应达到新平衡前ν(逆)> ν(正)
C.该温度下此反应的平衡常数K=1.44
D. 其他条件不变,再充入0.2molZ,平衡时X的体积分数增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将等物质的量的A、B混合于2L的密闭容器中,发生下列反应:3A(g)+B(g)![]() xC(g)+2D(g),经2min后测得D的浓度为0.5mol/L,c(A):c(B)=3:5,以C表示的平均速率v(C)=0.25mol·L1·min1,下列说法正确的是
xC(g)+2D(g),经2min后测得D的浓度为0.5mol/L,c(A):c(B)=3:5,以C表示的平均速率v(C)=0.25mol·L1·min1,下列说法正确的是
A. 反应速率v(B)=0.25 mol·L-1·min-1
B. 该反应方程式中x=1
C. 2min时,A的物质的量为1.5mol
D. 2min时,A的转化率为60%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,分别将四块形状相同、质量为7g的铁块同时投入下列四种溶液中。铁块最快溶解完的是( )
A.250.0mL2mol·L-1HClB.150.0mL2mol·L-1H2SO4
C.40.0mL5mol·L-1HClD.20.0mL18.4mol·L-1H2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢叠氮酸(HN3)和莫尔盐(NH4)2SO4·FeSO4·6H2O是两种常用原料。
(1)氨叠氮酸易溶于水,25℃时,该酸的电离常数为Ka=10×10-5
①氢叠氮酸在水溶液中的电离方程式为________________________________
②0.2mol/L的HN3溶液与0.1mol/L的NaOH溶液等体积混合后,恢复到25℃,混合溶液中各离子和HN3分子浓度由大到小的顺序为__________________________。
③已知T℃时,Ksp(CuN3)=5.0×10-9,Ksp(Cu2S)=2.5×10-48,则相同温度下,2CuN3(s)+S2-(aq)![]() Cu2S(s)+2N3-(aq)该反应正反应方向_________(“能”或“不能”)进行基本彻底,请通过计算说明_________________________。
Cu2S(s)+2N3-(aq)该反应正反应方向_________(“能”或“不能”)进行基本彻底,请通过计算说明_________________________。
(2)在FeSO4溶液中,加入(NH4)2SO4固体可制备莫尔盐晶体,为了测定产品纯度,称取ag产品溶于水,配制成500mL溶液,用浓度为cmol/L的酸性高锰酸钾溶液滴定,每次所取待测液体积均为25.00mL,实验结果记录如下:(已知莫尔盐的分子量为392)
实验次数 | 第一次 | 第二次 | 第三次 |
消耗KMnO4溶液体积/mL | 25.52 | 25.02 | 24.98 |
滴定终点的现象是________________,通过实验数据,计算该产品的纯度为_________(用含字母a、c的式子表示)。上表第一次实验中记录数据明显大于后两次,其原因可能是_________。
A.第一次滴定时,锥形瓶用待装液润洗
B.该酸性高锰酸钾标准液保存时间过长,部分变质
C.滴定前酸式滴定管中尖嘴处有气泡,滴定结束后气泡消失
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将V1mL未知浓度的NaOH溶液和V2mL1.50mol·L-1HCl混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50mL)。下列叙述正确的是( )
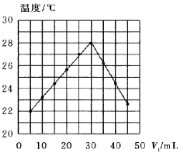
A.由图可知,做该实验时环境温度为22℃
B.该实验表明反应中化学能只能转化为热能
C.NaOH溶液的浓度约是1.00mol·L-1
D.该实验表明有水生成的反应都是放热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙烯是一种重要的化工原料,可由乙烷为原料制取。请回答下列问题:
(1)传统的热裂解法和现代的氧化裂解法的热化学方程式如下:
C2H6(g)=C2H4(g)+H2(g) ΔH1=+136kJ·mol-1
C2H6(g)+![]() O2(g)=C2H4(g)+H2O(g) ΔH2=-110kJ·mol-1
O2(g)=C2H4(g)+H2O(g) ΔH2=-110kJ·mol-1
已知水的汽化热为H2O(l)=H2O(g) ΔH3=+44kJ·mol-1
且反应相关的部分化学键键能数据如下:
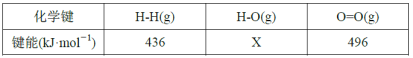
①由此计算x=___,通过比较ΔH1和ΔH2,说明氧化裂解法中通入氧气的作用是___。
②其他条件相同,对于氧化裂化法制乙烯的反应中,实验测得在T1和P1与T2和P2条件下该反应的C2H6平衡转化率相同,若T1>T2,则P1___P2(填“>”、“<”或“=”)。
③请求出下列反应的反应热:C2H6(g)+![]() O2(g)=C2H4(g)+H2O(l) ΔH3=___。
O2(g)=C2H4(g)+H2O(l) ΔH3=___。
(2)一定条件下,在体积为2L的密闭容器中,充入1molC2H6发生传统裂解法制乙烯。
①某温度下,10min后该反应达平衡,此时C2H6的物质的量浓度为0.2mol·L-1,从反应开始到平衡,乙烯的平均反应速率v(C2H4)=___。
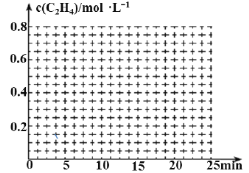
②在其它条件不变的情况下,15min时升高体系温度,20min达到新平衡,请在下边的坐标系中画出0~25 min,c(C2H4)随时间变化曲线:____。
(3)乙烷的氧化裂解反应产物中除了C2H4外,还存在CH4、CO、CO2等副产物(副反应均为放热反应),图1为温度对乙烷氧化裂解反应性能的影响。乙烷的转化率随温度的升高而升高的原因是___;反应的最佳温度为___(填选项序号)。
A.700℃ B.750℃ C.850℃ D.900℃
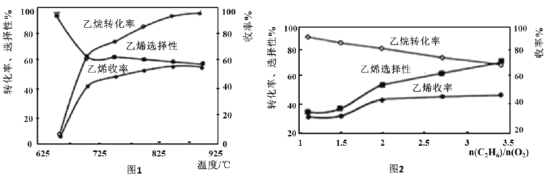
[乙烯选择性=![]() ;乙烯收率=乙烷转化率×乙烯选择性]
;乙烯收率=乙烷转化率×乙烯选择性]
(4)烃类氧化反应中,氧气含量低会导致反应产生积炭,堵塞反应管。图2为n(C2H6)/n(O2)的值对乙烷氧化裂解反应性能的影响。判断乙烷氧化裂解过程中![]() 的最佳值是___;判断的理由是___。
的最佳值是___;判断的理由是___。
(5)工业上,保持体系总压恒定为100kPa的条件下进行该反应,通常在乙烷和氧气的混合气体中掺混惰性气体(惰性气体的体积分数为70%),掺混惰性气体的目的是___。
(6)反应达平衡时,各组分的体积分数如下表:
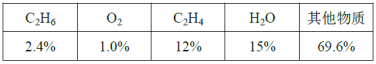
计算该温度下的平衡常数Kp=___(用平衡分压代替平衡浓度,平衡分压=总压×体积分数)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.将pH=4的盐酸稀释后,溶液中所有离子的浓度均降低
B.0.l0mol·L-1的氨水加水稀释后,溶液中c(NH4+)、c(OH-)变大
C.常温下,向水中加入少量Na2CO3固体后,c(H+)会减小,但Kw不变
D.若![]() LpH=11的NaOH溶液与
LpH=11的NaOH溶液与![]() LpH=3的HA溶液混合后显中性,则
LpH=3的HA溶液混合后显中性,则![]() ≤
≤![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列混合溶液中,各离子浓度的大小顺序正确的是
A. 10L0.1mol·L-1氨水与10L0.1mol·L-1盐酸混合:[Cl-]>[NH4+]>[OH-]>[H+]
B. 10mL0.1mol·L-1NH4Cl溶液与5mL0.2mol·L-1NaOH溶液混合:[Na+]=[Cl-]>[OH-]>[H+]
C. 10mL0.1mol·L-1CH3COOH溶液与5mL0.2mol·L-1NaOH溶液混合:[Na+]=[CH3COO-]>[OH-]>[H+]
D. 10mL0.5mol·L-1CH3COONa溶液与6mL1mol·L-1盐酸混合:[Cl-]>[Na+]>[OH-]>[H+]
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com