
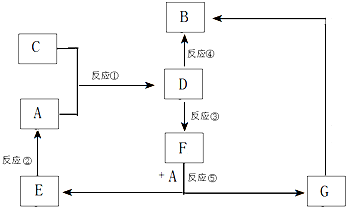
 A、B、C、D、E、F、G七种物质间存在如图所示的转化关系,其中A、B、D、G含有同种元素.已知:
A、B、C、D、E、F、G七种物质间存在如图所示的转化关系,其中A、B、D、G含有同种元素.已知:| 实验步骤 | 实验现象 | 用化学用语解释 |
| 将少量气体通入淀粉KI溶液 | 溶液最初变成 | (用离子方程式表示) |
| 继续通入气体 | 溶液逐渐变成无色 | (用化学方程式表示) |
| ||
| ||
| 实验步骤 | 实验现象 | 用化学用语解释 |
蓝 色 | Cl2+2I-═2Cl-+I2 | |
| 5Cl2+I2+6H2O═2HIO3+10HCl |


 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案科目:高中化学 来源: 题型:
| △ |

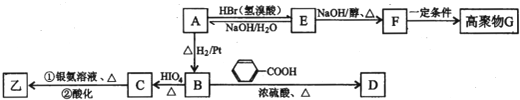
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、反应容器的压强不随时间而变化 |
| B、A气体和B气体的生成速率相等 |
| C、A、B、C三种气体的生成速率相等 |
| D、反应混合气体的密度不随时间而变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、加热 溶解 过滤 结晶 |
| B、溶解 过滤 蒸发 结晶 |
| C、加热 溶解 蒸发 过滤 |
| D、溶解 过滤 蒸馏 蒸发 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、电负性:F>O>N |
| B、第一电离能:Mg>Al>Na |
| C、结合质子能力:OH-<CH3COO-<Cl- |
| D、稳定性:H2O>H2S>H2Se |
查看答案和解析>>
科目:高中化学 来源: 题型:
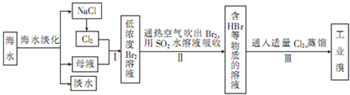
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、10mL0.1mol/L氨水与10mL0.1mol/L盐酸混合,c(Clˉ)>c(NH4+)>c(OHˉ)>c(H+) |
| B、10mL0.1mol/LNH4 Cl溶液与5mL0.2mol/LNaOH溶液混合,c(Na+)=c(Cl-)>c(OH-)>c(H+) |
| C、10mL0.1mol/LCH3COOH溶液与5mL0.2mol/LNaOH溶液混合,c(Na+)=c(CH3COOˉ)>c(OHˉ)>c(H+) |
| D、10mL0.5mol/LCH3COONa溶液与6mL1mol/L盐酸混合,c(Clˉ)>c(Na+)>c(OHˉ)>c(H+) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com