
| A. | 氢氧化钡溶液与硫酸铜溶液反应:Ba2++SO${\;}_{4}^{2-}$═BaSO4↓ | |
| B. | 向10mL1mol/LNa2CO3溶液中逐滴加入5mL1mol/L盐酸:2H++CO${\;}_{3}^{2-}$═CO2↑+H2O | |
| C. | 将过量SO2通入冷氨水中:SO2+NH3•H2O═HSO${\;}_{3}^{-}$+NH${\;}_{4}^{+}$ | |
| D. | 用稀硝酸洗涤试管内壁的银镜:Ag+2H++NO${\;}_{3}^{-}$═Ag++NO↑+H2O |
分析 A.漏写生成氢氧化铜的离子反应;
B.物质的量比为2:1,盐酸不足,生成碳酸氢根离子;
C.反应生成亚硫酸氢铵;
D.电子不守恒.
解答 解:A.氢氧化钡溶液与硫酸铜溶液反应的离子反应为Ba2++SO42-+Cu2++2OH-═BaSO4↓+Cu(OH)2↓,故A错误;
B.向10mL1mol/LNa2CO3溶液中逐滴加入5mL1mol/L盐酸的离子反应为CO32-+H+=HCO3-,故B错误;
C.将过量SO2通入冷氨水中的离子反应为SO2+NH3•H2O═HSO3-+NH4+,故C正确;
D.用稀硝酸洗涤试管内壁的银镜的离子反应为3Ag+4H++NO3-═3Ag++NO↑+2H2O,故D错误;
故选C.
点评 本题考查离子反应方程式的书写,为高频考点,把握发生的反应及离子反应的书写为解答的关键,侧重分析与应用能力的考查,注意离子反应中保留化学式的物质及电子、电荷守恒,题目难度不大.


 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:选择题
| A. | 氢键属于化学键,但比较弱 | |
| B. | 任何物质中都一定含有化学键 | |
| C. | NaOH中有离子键和共价键,则NaOH既属于离子化合物,又属于共价化合物 | |
| D. | Na2O2中既有离子键,又有非极性共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
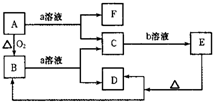 已知如图中A是固体单质,E是一种白色沉淀,F为密度最小的无色气体.且各种物质所含元素除H、O外,其余均为第三周期元素.
已知如图中A是固体单质,E是一种白色沉淀,F为密度最小的无色气体.且各种物质所含元素除H、O外,其余均为第三周期元素.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸性溶液中:Na+、K+、MnO4-、CO32- | |
| B. | 碱性溶液中:Na+、ClO-、SO42-、I- | |
| C. | 0.1mol•L-1NH4HCO3溶液中:K+、Na+、NO3-、Cl- | |
| D. | 0.1mol•L-1FeCl3溶液中:Fe2+、NH4+、SCN-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应过程中,若增大压强能提高SiCl4的转化率 | |
| B. | 若反应开始时SiCl4为1 mol,则达到平衡时,吸收热量为Q kJ | |
| C. | 反应至4 min时,若HCl浓度为0.12 mol•L-1,则H2的反应速率为0.03 mol•(L•min-1) | |
| D. | 当反应吸收热量为0.025Q kJ时,生成的HCl通入100 mL 1 mol•L-1的NaOH溶液中恰好反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
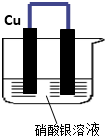 如图所示,将铁、铜通过导线相连,置于硝酸银溶液中.
如图所示,将铁、铜通过导线相连,置于硝酸银溶液中.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com