
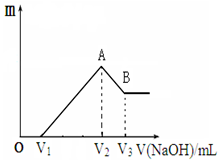
 将镁、铝的混合物共0.1mol,溶于200mL 2.5mol•L-1的盐酸溶液中,然后再滴加2mol•L-1的NaOH溶液.请回答下列问题:
将镁、铝的混合物共0.1mol,溶于200mL 2.5mol•L-1的盐酸溶液中,然后再滴加2mol•L-1的NaOH溶液.请回答下列问题:分析 由图可知,从开始至加入NaOH溶液V1mL,没有沉淀生成,说明原溶液中盐酸溶解Mg、Al后,盐酸有剩余,此时发生的反应为H++OH-=H2O;
继续滴加NaOH溶液,到氢氧化钠溶液为V2时,沉淀量最大,此时为Mg(OH)2和Al(OH)3,此时发生的反应为Mg2++2OH-=Mg(OH)2、Al3++3OH-=Al(OH)3,溶液为氯化钠溶液;再继续滴加NaOH溶液,氢氧化铝与氢氧化钠反应生成偏铝酸钠与水,发生反应Al(OH)3+OH-=AlO2-+2H2O;
由图可知,0~V1发生H++OH-=H2O,V1~V2 Mg2+、Al3+转化为沉淀,B→C段发生反应Al(OH)3+OH-=AlO2-+2H2O,结合反应及原子守恒计算解答.
解答 解:从开始至加入NaOH溶液V1mL,没有沉淀生成,说明原溶液中盐酸溶解Mg、Al后,盐酸有剩余,此时发生的反应为H++OH-=H2O;
继续滴加NaOH溶液,到氢氧化钠溶液为V2时,沉淀量最大,此时为Mg(OH)2和Al(OH)3,此时发生的反应为Mg2++2OH-=Mg(OH)2、Al3++3OH-=Al(OH)3,溶液为氯化钠溶液;再继续滴加NaOH溶液,氢氧化铝与氢氧化钠反应生成偏铝酸钠与水,发生反应Al(OH)3+OH-=AlO2-+2H2O;
根据分析可知:0~V1发生反应H++OH-=H2O,V1~V2 Mg2+、Al3+转化为沉淀,B→C段发生反应Al(OH)3+OH-=AlO2-+2H2O,
(1)若V1=120mL,说明盐酸有剩余,剩余盐酸的物质的量为:2mol/L×0.12L=0.24mol,则和金属反应的盐酸的物质的量:2.5mol/L×0.2L-0.24mol=0.26mol,
设镁的物质的量是x,铝的物质的量是y,x+y=0.1、2x+3y=0.26,解得:x=0.04mol,y=0.06mol,
即:混合物中铝的物质的量为0.06mol,故答案为:0.06;
(2)V1~V2 Mg2+、Al3+转化为沉淀,A→B段发生反应Al(OH)3+OH-=AlO2-+2H2O,故答案为:Al(OH)3+OH-=AlO2-+2H2O;
(3)若在滴加NaOH溶液的过程中,欲使Mg2+、Al3+刚好沉淀完全,溶质是单一氯化钠,根据原子守恒知,n(NaOH)=n(HCl)=0.5mol,
所以需要氢氧化钠的体积为:$\frac{0.5mol}{2mol/L}$=0.25L=250mL,故答案为:250.
点评 本题以图象形式考查混合物反应的计算,题目难度中等,明确每一段图象发生的化学反应、知道拐点代表的含义及溶液中溶质的成分为解答关键,注意守恒思想的运用方法.


 黄冈创优卷系列答案
黄冈创优卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 容量瓶 | B. | 量筒 | C. | 碱式滴定管 | D. | 以上仪器均可 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl2的摩尔质量为71 | |
| B. | 12C、13C、14C是碳元素的三种核素,互称为同位素 | |
| C. | 0.012kg12C中所含的原子数称为阿伏加德罗常数 | |
| D. | 卢瑟福根据α粒子散射实验,提出了带核的原子结构模型 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2S和HCl | B. | Na2CO3和H2SO4 | C. | NaHCO3和HCl | D. | Na2SO3和 H2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硝酸钾和冰的熔化需克服相同类型的作用力 | |
| B. | 氢化物HA的沸点比HB高,是因为1molHA分子中的H-A键断裂时吸收的能量比1molHB分子中键断裂吸收的能量多 | |
| C. | 离子晶体在熔融状态下能导电是因为晶体受热时离子键被削弱,形成了自由移动的离子 | |
| D. | 非金属元素间只能形成共价化合物,金属和非金属元素间形成离子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 2014年我国的冶金行业深受经济危机的冲击,尤其是Al、Fe的价格下滑幅度很大.请完成下面问题:
2014年我国的冶金行业深受经济危机的冲击,尤其是Al、Fe的价格下滑幅度很大.请完成下面问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
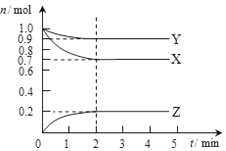 某温度时,在2L容器中X、Y、Z三种气态物质的物质的量(n)随时间(t)变化的曲线如图所示,由图中数据分析:
某温度时,在2L容器中X、Y、Z三种气态物质的物质的量(n)随时间(t)变化的曲线如图所示,由图中数据分析:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com