
【题目】现用质量分数为98%、密度为1.84 g·cm-3的浓硫酸来配制480 mL 0.5 mol·L-1的稀硫酸。可供选择的仪器如下图
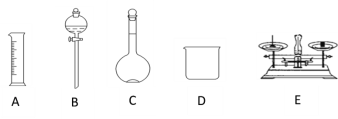
请回答下列问题:
(1)如图所示的仪器中配制溶液肯定不需要的是___________(填序号),配制上述溶液还需用到的玻璃仪器是_______________(填仪器名称)。
(2)使用容量瓶之前必须进行的操作是______________________________。
(3)经计算,需浓硫酸的体积为_____mL(小数点后保留 1位小数)。现有 ①10 mL
②50 mL ③100 mL三种规格的量筒,你选用的量筒是____(填序号)。
(4)配制溶液时,一般可分为以下几个步骤:
①量取 ②计算 ③稀释 ④摇匀 ⑤转移 ⑥洗涤 ⑦定容 其正确的操作顺序为:②→①→③→_________(填序号)。
(5)在配制过程中,其他操作都准确,下列操作使所配溶液浓度偏高的是_______ (填序号)
①洗涤量取浓硫酸的量筒,并将洗涤液转移到容量瓶中
②稀释后的硫酸溶液未等冷却至室温就转移到容量瓶中
③转移前,容量瓶中含有少量蒸馏水
④定容摇匀后,发现液面低于刻度线,又用胶头滴管加蒸馏水至刻度线
⑤定容时俯视刻度线
【答案】BE 胶头滴管、玻璃棒 检查容量瓶是否漏水 13.6 ② ⑤⑥⑦④ ①②⑤
【解析】
(1)根据配制一定物质的量浓度溶液的步骤判断仪器;
(2)使用容量瓶之前必须检查容量瓶是否漏水;
(3)依据![]() ,计算质量分数为98%、密度为1.84g/cm3的浓硫酸的物质的量浓度,再依据溶液稀释过程中所含溶质的物质的量不变计算需要浓硫酸的体积,依据浓硫酸体积选择合适规格的量筒;
,计算质量分数为98%、密度为1.84g/cm3的浓硫酸的物质的量浓度,再依据溶液稀释过程中所含溶质的物质的量不变计算需要浓硫酸的体积,依据浓硫酸体积选择合适规格的量筒;
(4)依据配制一定物质的量浓度溶液的一般步骤排序;
(5)依据配制一定物质的量浓度溶液的正确操作步骤判断,根据![]() 分析操作对溶质的物质的量或对溶液的体积的影响判断。
分析操作对溶质的物质的量或对溶液的体积的影响判断。
(1)用浓硫酸配制一定物质的量浓度的稀硫酸的步骤有:计算、量取、稀释、转移、洗涤、定容、摇匀等,使用的仪器有:量筒、烧杯、玻璃棒、容量瓶、胶头滴管,不需要的仪器有托盘天平和分液漏斗,还缺少的仪器:玻璃棒、胶头滴管;
故答案为:BE;胶头滴管、玻璃棒;
(2)使用容量瓶之前必须进行的操作是检查容量瓶是否漏水;
故答案为:检查容量瓶是否漏水;
(3)质量分数为98%、密度为1.84g/cm3的浓硫酸物质的量浓度为:![]() ,配制450mL溶液,应选择500mL容量瓶,实际配制500mL溶液,设需要浓硫酸体积为V,则依据溶液稀释过程中所含溶质的物质的量不变可得:V×18.4mol/L=0.5mol/L×0.5L,解得:V=0.0136L=13.6mL,应选择25mL量筒;
,配制450mL溶液,应选择500mL容量瓶,实际配制500mL溶液,设需要浓硫酸体积为V,则依据溶液稀释过程中所含溶质的物质的量不变可得:V×18.4mol/L=0.5mol/L×0.5L,解得:V=0.0136L=13.6mL,应选择25mL量筒;
故答案为:13.6;②;
(4)配制一定物质的量浓度溶液的一般步骤:计算、称量(量取)、溶解(稀释)、冷却、转移、洗涤、定容、摇匀等,所以正确的操作为:②→①→③→⑤→⑥→⑦→④;
故答案为:⑤⑥⑦④;
(5)①洗涤量取浓硫酸后的量筒,并将洗涤液转移到容量瓶中,导致量取的浓硫酸体积偏大,硫酸的物质的量偏大,溶液浓度偏高;
②稀释后的硫酸溶液未等冷却至室温就转移到容量瓶中,浓硫酸稀释产生大量的热,冷却后溶液体积偏小,溶液浓度偏高;
③转移前,容量瓶中含有少量蒸馏水,对溶液浓度无影响;
④定容摇匀后,发现液面低于刻度线,又用胶头滴管加蒸馏水至刻度线,导致溶液体积偏大,溶液浓度偏低;
⑤定容时俯视刻度线,导致溶液体积偏小,配制溶液的浓度偏高;
综上所述,以上操作会使所配溶液浓度偏高的是①②⑤;
故答案为:①②⑤。


科目:高中化学 来源: 题型:
【题目】民间艺术是劳动人民智慧的结晶,下列中国传统民间艺术在表演过程中涉及化学变化的是
A | B | C | D |
刺绣 | 打树花 | 剪纸 | 织锦 |
|
|
|
|
用针线在织物上 绣制图案 | 将熔化的铁水泼向 空中,迸溅出火花 | 用剪刀或刻刀在纸上剪刻花纹 | 用提花机织出图案 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,固定容积的密闭容器中反应:2NO2(g)![]() O2(g)+2NO(g) ΔH>0,达到平衡。当改变其中一个条件X时,Y随X的变化符合图中曲线的是
O2(g)+2NO(g) ΔH>0,达到平衡。当改变其中一个条件X时,Y随X的变化符合图中曲线的是
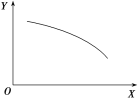
A. 当X表示温度时,Y表示O2的物质的量
B. 当X表示压强时,Y表示NO2的转化率
C. 当X表示反应时间时,Y表示混合气体的密度
D. 当X表示NO2的物质的量时,Y表示O2的物质的量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏伽德罗常数的值,下列叙述正确的是( )
A.标准状况下,22.4 L H2O中含有的分子数为NA
B.1.7 g OH-中含有的质子数为NA
C.常温常压下,16 g O2中含有的氧原子数为NA
D.物质的量浓度为0.5 mol·L-1 MgCl2 溶液中,含有Cl-数目为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将等物质的量的X、Y气体充入一个密闭容器中,在一定条件下发生如下反应并达到平衡:X(g)+Y(g) ![]() 2Z(g) ΔH<0。当改变某个条件并达到新平衡后,下列叙述正确的是( )
2Z(g) ΔH<0。当改变某个条件并达到新平衡后,下列叙述正确的是( )
A. 升高温度,X的体积分数减小
B. 增大压强(缩小容器体积),Z的浓度不变
C. 保持容器体积不变,充入一定量的惰性气体,Y的浓度不变
D. 保持容器体积不变,充入一定量的Z,X的体积分数增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将红热的固体单质甲放入显黄色的浓乙溶液中,剧烈反应,产生混合气体A,A在常温下不与空气作用,发生如图所示的变化。
气体A![]()
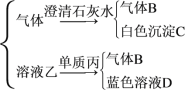
(1)写出下列物质的化学式:丙__,B___,C___,D___。
(2)写出甲跟乙反应的化学方程式:__。
(3)单质丙与溶液乙反应生成气体B的离子方程式:__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】健康人体内含铁元素大约 2~3g,人体内铁元素以亚铁离子和三价铁离子的形式存在,Fe2+易被吸收,所以给贫血者补充铁元素时,应补充含 Fe2+的亚铁盐。“速力菲”(主要成分:琥珀酸亚铁,呈暗黄色)是市场上一种常见的补铁药物。该药品不溶于水但能溶于人体中的胃酸。某同学为了检测“速力菲”药片中Fe2+的存在,设计并进行了如下实验:

(1) 试剂1的名称是__________;试剂2的化学式为______________。
(2) 加入新制氯水,溶液中发生反应的离子方程式是_____________________________。
(3) 加入试剂2 时溶液为淡红色说明 “速力菲”中的 Fe2+已部分氧化,一般在服用“速力菲”时,同时服用维生素C,说明维生素C具有___________性。
(4) 不仅溶液中Fe2+易被氧化成Fe3+,溶液中白色沉淀Fe(OH)2更易被O2氧化,请写出反应的化学方程式________________________,现象为__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,0.1 mol·L-1某一元酸(HA)溶液中c(OH-)/c(H+)=1×10-8下列叙述正确的是
A. 该一元酸的电离方程式为HA = H++ A-
B. 该溶液中由水电离出的c(H+)=1×10-11mol·L-1
C. 该溶液中水的离子积常数为1×10-22
D. 将pH=11的NaOH溶液V1L与V2L 0.1 mol·L-1该一元酸(HA)溶液混合,若混合溶液的pH=7,则混合溶液中有关离子浓度为c(Na+)>c(OH-)>c(A-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ、在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)![]() CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
t℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应为____________反应(选填吸热、放热)。
(2)能判断该反应是否达到化学平衡状态的依据是_________。
a.容器中压强不变 b.混合气体中 c(CO)不变
c.υ正(H2)=υ逆(H2O) d.c(CO2)=c(CO)
(3)某温度下,平衡浓度符合下式:c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为 _________℃。
Ⅱ、向一体积不变的密闭容器中充入2 mol A、0.6 mol C和一定量的B三种气体,一定条件下发生反应2A(g)+B(g) ![]() 3C(g),各物质的浓度随时间变化的关系如图1所示,其中如t0~t1阶段c(B)未画出。图2为反应体系中反应速率随时间变化的情况,且t2、t3、t4各改变一种不同的条件。
3C(g),各物质的浓度随时间变化的关系如图1所示,其中如t0~t1阶段c(B)未画出。图2为反应体系中反应速率随时间变化的情况,且t2、t3、t4各改变一种不同的条件。
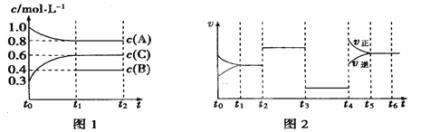
(1)若t1=15 min,则t0~t1阶段以C的浓度变化表示的反应速率V(C)=_____。
(2)t3时改变的条件为___________,B的起始物质的量为_______。
(3)t4~t5阶段,若A的物质的量减少了0.01 mol,而此阶段中反应体系吸收能量为a kJ,写出此条件下该反应的热化学方程式___________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com