
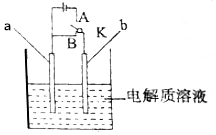
 ÓĆČēĶ¼ĖłŹ¾×°ÖĆ½ųŠŠŹµŃ飬Ēė»Ų“šĻĀĮŠĪŹĢā£ŗ
ÓĆČēĶ¼ĖłŹ¾×°ÖĆ½ųŠŠŹµŃ飬Ēė»Ų“šĻĀĮŠĪŹĢā£ŗ·ÖĪö £Ø1£©¢Łµ±KÓėBĮ¬½Ó£¬ŹōÓŚŌµē³Ų×°ÖĆ£¬µ±µē½āÖŹČÜŅŗĪŖĒāŃõ»ÆÄĘČÜŅŗŹ±£¬ĀĮÄÜÓėĒāŃõ»ÆÄĘČÜŅŗ·“Ó¦²śÉśĘ«ĀĮĖįÄĘŗĶĒāĘų£¬ĀĮŹ§µē×Ó·¢ÉśŃõ»Æ·“Ó¦£¬×Ü·“Ó¦¼õøŗ¼«·“Ó¦Ź½µĆµ½Õż¼«·“Ó¦£»
¢Śµ±µē½āÖŹČÜŅŗĪŖÅØĻõĖįČÜŅŗ£¬ĀĮÓöÅØĻõĖį·¢Éś¶Ū»Æ£¬ŌņĶ×÷øŗ¼«£¬ĶŹ§µē×Ó·¢ÉśŃõ»Æ·“Ó¦£»
£Ø2£©µ±KÓėAĮ¬½Ó£¬ŹōÓŚµē½ā×°ÖĆ£¬µē½āÖŹČÜŅŗĪŖ±„ŗĶNa2CO3ČÜŅŗ£¬aÓėµēŌ“Õż¼«ĻąĮ¬µÄŹĒŃō¼«£¬ĒāŃõøłŹ§µē×Ó·¢ÉśŃõ»Æ·“Ó¦£¬bÓėµēŌ“øŗ¼«ĻąĮ¬µÄŹĒŅõ¼«£¬ĒāĄė×ӵƵē×Ó·¢Éś»¹Ō·“Ó¦£¬ŹµÖŹŹĒµē½āĖ®£¬µē½āŗóČÜŅŗČŌŹĒ±„ŗĶČÜŅŗ£¬Ōņµē½āĒ°ČÜŅŗµÄÖŹĮæ·ÖŹż=$\frac{Īö³öĢ¼ĖįÄʵÄÖŹĮæ}{Īö³ö¾§ĢåµÄÖŹĮæ+µē½āĻūŗÄĖ®µÄÖŹĮæ}$”Į100%£®
½ā“š ½ā£ŗ£Ø1£©¢Łµ±KÓėBĮ¬½Ó£¬ŹōÓŚŌµē³Ų×°ÖĆ£¬µ±µē½āÖŹČÜŅŗĪŖĒāŃõ»ÆÄĘČÜŅŗŹ±£¬ĀĮÄÜÓėĒāŃõ»ÆÄĘČÜŅŗ·“Ó¦²śÉśĘ«ĀĮĖįÄĘŗĶĒāĘų£¬×Ü·“Ó¦ĪŖ£ŗ2Al+2NaOH+2H2O=2NaAlO2+3H2”ü£¬ĀĮ×÷øŗ¼«£¬ĀĮŹ§µē×Ó·¢ÉśŃõ»Æ·“Ó¦£¬µē¼«·“Ó¦ĪŖ£ŗ2Al-6e-+8OH-=2AlO2-+4H2O£¬×Ü·“Ó¦¼õøŗ¼«·“Ó¦Ź½µĆµ½Õż¼«·“Ó¦£ŗ6H2O+6e-=3H2”ü+6OH-£¬
¹Ź“š°øĪŖ£ŗAl£»6H2O+6e-=3H2”ü+6OH-£»
¢Śµ±µē½āÖŹČÜŅŗĪŖÅØĻõĖįČÜŅŗ£¬ĀĮÓöÅØĻõĖį·¢Éś¶Ū»Æ£¬ŌņĶ×÷øŗ¼«£¬ĶŹ§µē×Ó·¢ÉśŃõ»Æ·“Ó¦£¬µē¼«·“Ó¦ĪŖ£ŗCu-2e-=Cu2+£¬
¹Ź“š°øĪŖ£ŗCu£»Cu-2e-=Cu2+£»
£Ø2£©µ±KÓėAĮ¬½Ó£¬ŹōÓŚµē½ā×°ÖĆ£¬µē½āÖŹČÜŅŗĪŖ±„ŗĶNa2CO3ČÜŅŗ£¬aÓėµēŌ“Õż¼«ĻąĮ¬µÄŹĒŃō¼«£¬ĒāŃõøłŹ§µē×Ó·¢ÉśŃõ»Æ·“Ó¦²śÉśŃõĘų£¬bÓėµēŌ“øŗ¼«ĻąĮ¬µÄŹĒŅõ¼«£¬ĒāĄė×ӵƵē×Ó·¢Éś»¹Ō·“Ó¦²śÉśĒāĘų£¬ŹµÖŹŹĒµē½āĖ®£¬×Ü·“Ó¦ĪŖ£ŗ2H2O$\frac{\underline{\;µē½ā\;}}{\;}$2H2”ü+O2”ü£¬
µē½āŅ»¶ĪŹ±¼äŗó£¬bµē¼«ÉĻŹÕ¼Æµ½±źæöĻĀVLĘųĢåŹ±£¬ŌņĒāĘųĪļÖŹµÄĮæĪŖ£ŗn=$\frac{VL}{22.4L/mol}=\frac{V}{22.4}mol$£¬ĻūŗÄĖ®µÄÖŹĮæĪŖ£ŗ$\frac{V}{22.4}$mol”Į18g/mol=$\frac{18V}{22.4}$g£¬
Īö³ömgNa2CO3•10H2OÖŠ£¬Ģ¼ĖįÄʵÄÖŹĮæĪŖ£ŗm”Į$\frac{106}{286}$g£¬µē½āŗóČÜŅŗČŌŹĒ±„ŗĶČÜŅŗ£¬
µē½āĒ°ČÜŅŗµÄÖŹĮæ·ÖŹż=$\frac{Īö³öĢ¼ĖįÄʵÄÖŹĮæ}{Īö³ö¾§ĢåµÄÖŹĮæ+µē½āĻūŗÄĖ®µÄÖŹĮæ}$”Į100%=$\frac{m”Į\frac{106}{286}}{m+\frac{18V}{22.4}}$”Į100%£¬
¹Ź“š°øĪŖ£ŗŃõ»Æ£»$\frac{m”Į\frac{106}{286}}{m+\frac{18V}{22.4}}$”Į100%£®
µćĘĄ ±¾Ģā×ŪŗĻæ¼²éŌµē³ŲŗĶµē½ā³ŲµÄ¹¤×÷ŌĄķ£¬²ąÖŲÓŚæ¼²éѧɜµē¼«µÄÅŠ¶ĻŅŌ¼°µē¼«·“Ó¦Ź½µÄŹéŠ“£¬ĢāÄæÄŃ¶Č½Ļ“ó£¬ŌŚÅŠ¶ĻÕżøŗ¼«Ź±²»ÄÜÖ»æ¼ĀĒ½šŹōµÄ»īĘĆŠŌ£¬ŅŖ×¢Ņā°ŃĪÕµē½āÖŹČÜŅŗµÄŠŌÖŹ£®


 æĪĢĆĮ·¼Ó²āĻµĮŠ“š°ø
æĪĢĆĮ·¼Ó²āĻµĮŠ“š°ø ĒįĖÉæĪĢƵ„ŌŖ²āŹŌAB¾ķĻµĮŠ“š°ø
ĒįĖÉæĪĢƵ„ŌŖ²āŹŌAB¾ķĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | CsĻŌ+3¼Ū£¬I”¢Cl¾łĻŌ-1¼Ū | |
| B£® | ŌŚCsICl2ČÜŅŗÖŠĶØČėSO2ĘųĢ壬ӊĮņĖįÉś³É | |
| C£® | CsĻŌ+1¼Ū£¬ClĻŌ+1¼Ū£¬IĻŌ-3¼Ū | |
| D£® | ŌŚCsICl2ČÜŅŗÖŠĶØČėCl2£¬ÓŠµ„ÖŹµāÉś³É |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
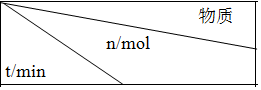 | NO | N2 | CO2 |
| 0 | 2.00 | 0 | 0 |
| 10 | 1.16 | 0.42 | 0.42 |
| 20 | 0.80 | 0.60 | 0.60 |
| 30 | 0.80 | 0.60 | 0.60 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
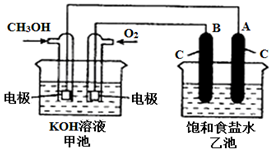 ¼×“¼ŹĒŅ»ÖÖæÉŌŁÉśÄÜŌ“£¬¾ßÓŠ¹ć·ŗµÄæŖ·¢ŗĶÓ¦ÓĆĒ°¾°£®ČēĶ¼ŹĒÓĆ¼×“¼Č¼ĮĻµē³Ųµē½ā±„ŗĶŹ³ŃĪĖ®µÄ×°ÖĆŹ¾ŅāĶ¼£®ŅŃÖŖ¼×³ŲµÄ×Ü·“Ó¦Ź½ĪŖ£ŗ2CH3OH+3O2+4KOHØT2K2CO3+6H2O£®
¼×“¼ŹĒŅ»ÖÖæÉŌŁÉśÄÜŌ“£¬¾ßÓŠ¹ć·ŗµÄæŖ·¢ŗĶÓ¦ÓĆĒ°¾°£®ČēĶ¼ŹĒÓĆ¼×“¼Č¼ĮĻµē³Ųµē½ā±„ŗĶŹ³ŃĪĖ®µÄ×°ÖĆŹ¾ŅāĶ¼£®ŅŃÖŖ¼×³ŲµÄ×Ü·“Ó¦Ź½ĪŖ£ŗ2CH3OH+3O2+4KOHØT2K2CO3+6H2O£®²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ¶ąŃ”Ģā
| A£® | 140”ꏱ£¬ĪŽĖ®ŅŅ“¼ÓėÅØĮņĖį¹²ČČæÉÖʱøŅŅĻ© | |
| B£® | ĶłÓĶÖ¬ÖŠ¼ÓĻ”ĮņĖįÓėÖ®¹²ČČæÉ·¢ÉśŌķ»Æ·“Ó¦ | |
| C£® | æÉÓƵāČÜŅŗ¼ģŃéµķ·ŪŹĒ·ńĖ®½āĶźČ« | |
| D£® | ŃéÖ¤äåŅŅĶéÖŠµÄäåŌŖĖŲ£¬æÉÖ±½Ó¼ÓAgNO3ČÜŅŗ¹Ū²ģŹĒ·ńÓŠµ»ĘÉ«³ĮµķÉś³É |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| Ń”Ļī | X | Y | Z | M |
| A | Fe£Øs£© | FeCl2 | FeCl3 | Cl2 |
| B | NaOH£Øaq£© | Na2CO3 | NaHCO3 | CO2 |
| C | NH3£Øg£© | NO | NO2 | O2 |
| D | NaOH | NOAlO2 | Al£ØOH£©3 | AlCl3 |
| A£® | A | B£® | B | C£® | C | D£® | D |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | NaHCO3+HClØTNaCl+H2O+CO2”ü | B£® | 2KClO3$\frac{\underline{\;MnO_{2}\;}}{”÷}$ 2KCl+2O2”ü | ||
| C£® | S+O2$\frac{\underline{\;µćČ¼\;}}{\;}$SO2 | D£® | 2CuO+C$\frac{\underline{\;\;”÷\;\;}}{\;}$2Cu+CO2 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | 25”ę£¬pH=13µÄNaOHČÜŅŗÖŠŗ¬ÓŠOH-µÄŹżÄæĪŖ0.1NA | |
| B£® | ³£ĪĀĻĀ£¬1 L 0.1 mol•L-1µÄNH4NO3ČÜŅŗÖŠµŖŌ×ÓŹżĪŖ0.2NA | |
| C£® | 10 L pH=1µÄĮņĖįČÜŅŗÖŠŗ¬ÓŠµÄH+ĪŖ2NA | |
| D£® | ÓūÅäÖĘ1.00 L 1.00 mol•L-1µÄNaClČÜŅŗ£¬æɽ«58.5 g NaClČÜÓŚ1.00 LĖ®ÖŠ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ¼ĘĖćĢā
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com