
【题目】含有C=C的有机物与O3作用形成不稳定的臭氧化物,臭氧化物在还原剂存在下,与水作用分解为羰基化合物,总反应为:![]()

![]() +
+![]() (R1、R2、R3、R4为H或烷基)。以下四种物质发生上述反应,所得产物为纯净物且含有醛基的是( )
(R1、R2、R3、R4为H或烷基)。以下四种物质发生上述反应,所得产物为纯净物且含有醛基的是( )
A. (CH3)2C=C(CH3)2 B. CH2=CHCH=CHCH=CH2 C.  D.
D. ![]()
科目:高中化学 来源: 题型:
【题目】碳是形成化合物种类最多的元素,其单质及化合物是人类生产生活的主要能源物质。
请回答下列问题:
(1)有机物M经过太阳光光照可转化成N,转化过程如下:
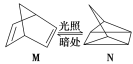 ΔH=+88.6 kJ·mol-1
ΔH=+88.6 kJ·mol-1
则M、N相比,较稳定的是 。
(2)已知CH3OH(l)的燃烧热为238.6 kJ·mol-1,CH3OH(l)+![]() O2(g)=CO2(g)+2H2(g) ΔH=-a kJ·mol-1,则a 238.6(填“>”、“<”或“=”)。
O2(g)=CO2(g)+2H2(g) ΔH=-a kJ·mol-1,则a 238.6(填“>”、“<”或“=”)。
(3)使Cl2和H2O(g)通过灼热的炭层,生成HCl和CO2,当有1 mol Cl2参与反应时释放出145 kJ热量,写出该反应的热化学方程式: 。
(4)火箭和导弹表面的薄层是耐高温物质。将石墨、铝粉和二氧化钛按一定比例混合在高温下煅烧,所得物质可作耐高温材料,4Al(s)+3TiO2(s)+3C(s)=2Al2O3(s)+3TiC(s) ΔH=-1 176 kJ·mol-1,则反应过程中,每转移1 mol电子放出的热量为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 可用蒸发结晶的方法从碘水中提取碘单质
B. 碘化银可用于人工降雨
C. 酒精在实验台上着火可用水作灭火剂
D. 氢气还原氧化铜要先加热再通氢气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解质溶液电导率越大导电能力越强。常温下用0.0200mol/L盐酸分别滴定10.00mL浓度均为0.0200mol/L的NaOH溶液和二甲胺[(CH3)2NH]溶液(二甲胺在水中电离与氨相似)。利用传感器测得滴定过程中溶液的电导率如图所示。下列说法不正确的是
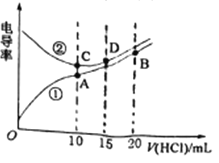
A. 曲线②代表滴定NaOH溶液的曲线,在相同温度下,水的电离程度A>C>D>B
B. 常温下,测得A点溶液的pH=6,则二甲胺常温下电离常数Kb约为10-4
C. 向二甲胺溶液中滴加盐酸10~20mL过程中:c(Cl-)>c[(CH3)2NH2+]>c(H+)>c(OH-)
D. B点溶液中:c(H+)=c(OH-)+ c[(CH3)2NH2+]+2c[(CH3)2NH·H2O]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于硅的说法正确的是( )
A.单质硅的导电性介于导体和绝缘体之间
B.单质硅是制造光导纤维的材料
C.硅为非金属,熔点低,但有金属光泽
D.晶体硅为非金属,属于绝缘体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.镓(Ga)位于周期表的第四周期,与Al同主族,主要存在Ga3+、GaO2-两种离子形式,被广泛应用于电子工业。
(1)用铝粉和Fe2O3做铝热反应实验,需要的试剂还有__________________。
a.KClO3 b. KCl c. MnO2 d. Mg
(2)半导体材料氮化镓由Ga与NH3在一定条件下发生置换反应生成。该过程每生成1molGaN(s)放出热量15.4kJ。镓在周期表中的序号_____________,写出该反应的热化学方程式_________________。
(3)工业上用电解法精炼镓。具体原理如图所示,已知:金属的活动性Zn>Ga>Fe>Cu

①电解精炼镓一段时间后形成的阳极泥主要有______________
②已知精炼时阴极反应:GaO2-+3e-+2H2O=Ga+4OH- 。阳极的电极反应方程式:___________________________________;
Ⅱ.用废铁皮制取铁红(Fe2O3)的部分流程示意图如下:

(4)步骤I温度不能过高。因为:_______________________________。
(5)步骤II中发生反应4Fe(NO3)2+O2+(2n+4)H2O=2Fe2O3·nH2O+8HNO3,生成的硝酸又将废铁皮中的铁转化为Fe(NO3)2。
写出后者反应的离子方程式______________________________________。
(6)上述生产流程中,能体现“绿色化学”思想的是______________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜、硼、硅、砷等元素的化合物是制造新型激光武器和新型太阳能电池的重要材料。回答下列问题:
(1)基态硅原子电子占据的最高能层符号是_____,其中能量最高的电子所占据能级的原子轨道有_____个伸展方向,原子轨道呈_____形。
(2)在硫酸铜溶液中通入过量的氨气,小心蒸发,最终得到深蓝色的[Cu(NH3)4]SO4晶体,晶体中含有的化学键除普通共价键外,还有____________。
(3)硒为第四周期元素,相邻的元素有砷和溴,则三种元素的第一电离能从大到小的顺序为________(用元素符号表示)。H2SeO3的酸性_______H2SeO4(填“强于”或“弱于”),原因是___________(从分子结构的角度回答)。
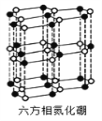
(4)氮化硼(BN)晶体有多种相结构。六方相氮化硼是通常存在的稳定相,与石墨相似,具有层状结构,可作高温润滑剂。它的晶体结构如下左图所示。六方相氮化硼______π键(填“含有”或“不含”),其质地软的原因是_________。NaBH4是一种重要的储氢载体,阴离子的的立体结构为_______。
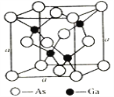
(5)砷化镓是优良的第三代半导体材料。如上图所示为GaAs的晶胞结构。
①与GaAs互为等电子体的一种原子晶体的化学式为________。
②已知晶胞的密度是ρ g·cm3,阿伏加德罗常数值为NA,棱长a=_____pm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应 4A (s)+3B(g)![]() 2C( g) +D(g),在体积恒定的密闭容器中进行,经2 min达平衡,B的浓度减少了0.6 mol/L。下列说法正确的是( )
2C( g) +D(g),在体积恒定的密闭容器中进行,经2 min达平衡,B的浓度减少了0.6 mol/L。下列说法正确的是( )
A. 用A表示的反应速率是0.4 mol/(L·min)
B. 气体的平均相对分子质量不变可以说明该反应达到化学平衡
C. 压强不变可以说明该反应达到化学平衡状态
D. 向容器中充入 Ne,压强增大,反应速率加快
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】①已知t℃时AgCI的Ksp=2×10-10;②在t℃时Ag2CrO4在水中的沉淀溶解平衡曲线如图所示。下列说法正确的是

A.在t℃时,Ag2CrO4的Ksp为1×10-9
B.在饱和Ag2CrO4溶液中加入K2CrO4可使溶液由Y点到X点
C.在t℃时,以0.01 mol/LAgNO3溶液滴定20 mL 0.01 mol/L KCI和0.01 mol/L的K2CrO4的混和溶液,CrO42-先沉淀
D.在t℃时,反应Ag2CrO4(s)+2Cl-(aq)![]() 2AgCl(s)+CrO42-(aq)的平衡常数K=2.5×107
2AgCl(s)+CrO42-(aq)的平衡常数K=2.5×107
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com