
| A. | 物质的量是国际单位制中七个基本物理量之一 | |
| B. | CH3COOK的摩尔质量为98 g | |
| C. | 1 mol CH3COOK含有2 mol氧 | |
| D. | 1 molCH3COOK含有3×6.02×1023个氢元素 |
分析 A.摩尔是单位,不是国际单位制中的基本物理量;
B.摩尔质量的单位是g/mol;
C.指代不明确,氧是氧原子还是氧分子;
D.根据N=nNA结合一个分子中含有的氢原子个数计算总氢原子个数.
解答 解:A.物质的量是国际单位制中七个基本物理量之一,单位是mol,故A正确;
B.质量的单位是g,摩尔质量的单位是g/mol,故B错误;
C.1molCH3COOK含有2mol氧原子,故C错误;
D.1mol CH3COOK含有NA个醋酸根离子,一个醋酸根离子中含有3个H,所以1mol CH3COOK含有3×6.02×1023个H原子,而不是氢元素,故D错误;
故选A.
点评 本题考查了物质的量的有关问题,难度不大,注意摩尔是单位不是基本物理量,为易错点.


科目:高中化学 来源: 题型:选择题
| A. | ①③⑤ | B. | ②④⑥ | C. | ②④⑤ | D. | ②⑦⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间/s | 0 | 20 | 40 | 60 | 80 |
| c(N2O4)/mol•L-1 | 0.100 | c1 | 0.050 | c3 | c4 |
| c(NO2)/mol•L-1 | 0.000 | 0.060 | c2 | 0.120 | 0.120 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入水时,平衡向逆反应方向移动 | |
| B. | 加入少量0.1 mol/L HCl溶液,溶液中c(H+)不变 | |
| C. | 加入少量NaOH固体,平衡向正反应方向移动 | |
| D. | 加入少量CH3COONa固体,平衡向正反应方向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
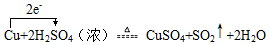 .实验测得,反应中生成了标准状况下的SO2气体44.8L,则耗氧化剂的物质的量为2mol.
.实验测得,反应中生成了标准状况下的SO2气体44.8L,则耗氧化剂的物质的量为2mol.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com