
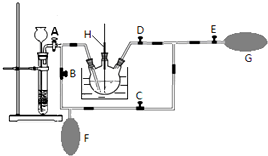
分析 (1)熔融固体物质需要在坩埚内加热,加热熔融物含有碱性KOH应用铁坩埚;
(2)①该操作的目的是将气囊F中的二氧化碳排出,据此判断正确的操作方法;
②根据“K2MnO4溶液显绿色”可知,如果该歧化反应结束,则反应后的溶液不会显示绿色;
(3)蒸发溶液获得晶体时不能蒸干,避免固体飞溅;高锰酸钾在温度较高时容易分解,需要低温下烘干;
(4)根据n=cV计算出25mL待测液消耗的醋酸钠的物质的量,再根据反应方程式计算出25mL待测液中含有高锰酸钾的物质的量,从而计算出样品中含有高锰酸钾的物质的量,然后根据m=nM计算出高锰酸钾的质量,最后计算出纯度;待测液被蒸馏水稀释后浓度减小,测定的样品中含有的高锰酸钾物质的量减小,纯度减小.
解答 解:(1)熔融固体物质需要在坩埚内加热,加热熔融物中含有碱性KOH,瓷坩埚中含有二氧化硅,二氧化硅能够与氢氧化钾反应,所以应用铁坩埚,所以④正确,
故答案为:④;
(2)①待气囊F收集到较多气体时,需要将气囊F中二氧化碳排出到热K2MnO4溶液中,所以需要关闭A、C,打开B、D、E,轻轻挤压气囊F,从而使CO2气体缓缓地压入K2MnO4溶液中再次反应,
故答案为:A、C;B、D、E;
②由于K2MnO4溶液显绿色,所以用玻璃棒蘸取三颈烧瓶内的溶液点在滤纸上,若滤纸上只有紫红色痕迹,无绿色痕迹,表明反应已歧化完全,
故答案为:用玻璃棒蘸取三颈烧瓶内的溶液点在滤纸上,若滤纸上只有紫红色痕迹,无绿色痕迹,表明反应已歧化完全;
(3)蒸发溶液获得高锰酸钾时不能蒸干,避免固体飞溅及高锰酸钾的分解,所以应该加热到溶液表面出现晶膜时停止加热,并且应采用低温烘干的方法来干燥产品,避免高锰酸钾晶体受热发生分解,
故答案为:溶液表面出现晶膜为止;高锰酸钾晶体受热易分解;
(4)50mL 0.1000mol•L-1草酸钠标准溶液中含有醋酸钠的物质的量为:0.1mol/L×0.05L=0.005mol,根据反应2MnO4-+5C2O42-+16H+═2Mn2++10CO2↑+8H2O可知,消耗0.005mol醋酸钠需要消耗高锰酸根离子的物质的量为:0.005mol×$\frac{5}{2}$=0.002mol,
500mL配制的样品溶液中含有高锰酸根离子的物质的量为:0.002mol×$\frac{500mL}{25mL}$=0.04mol,
则样品中含有高锰酸钾的质量为:0.04mol×158g•mol-1=6.32g,
则高锰酸钾产品的纯度为:$\frac{6.32g}{7.245g}$×100%=87.23%;
若移液管用蒸馏水洗净后没有用待测液润洗或烘干,则导致待测液浓度减小,滴定时消耗的标准液体积偏小,测定结果偏小,
故答案为:87.23%;偏小.
点评 本题通过高锰酸钾的制备,考查了物质制备实验方案的设计方法,题目难度中等,涉及了样品中纯度计算、化学实验基本操作方法、物质制备原理等知识,明确物质制备原理及流程为解答本题的关键,试题充分考查了学生的分析、理解能力及化学实验、化学计算的能力.


 黄冈360度定制密卷系列答案
黄冈360度定制密卷系列答案 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案 名校提分一卷通系列答案
名校提分一卷通系列答案科目:高中化学 来源: 题型:选择题
| A. | 加5 mL水,c (H+)增大 | B. | 加少量NaCl固体,c (H+)不变 | ||
| C. | 加少量碳酸钙粉末,c(HClO)升高 | D. | 加少量Na2SO3固体,溶液pH升高 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验操作 | 实验现象 |
向2mL0.1mol/LBaCl2 溶液(填化学式)中通入SO2 | 试管内有白色沉淀产生 |
| 实验操作 | 实验数据 |
| 向烧杯中加入煮沸了的0.1mol/L的BaCl2溶液25mL,再加入25mL植物油,冷却至室温,用pH传感器测定溶液pH随时间(t)的变化曲线 | 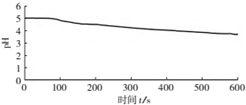 图1:向BaCl2(无氧)溶液中通入SO2 |
| 向烧杯中分别加入25mL 0.1mol/L的BaCl2溶液、Ba(NO3)2溶液,通入SO2,用pH传感器分别测定溶液pH随时间(t)变化的曲线. | 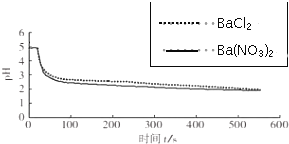 图2:分别向BaCl2、Ba(NO3)2溶液中通入SO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
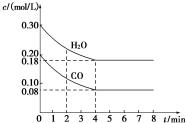 在一体积为1L的密闭容器中,通入一定量的CO和H2O,在T1℃时发生如下反应:CO (g)+H2O(g)?CO2(g)+H2(g)△H<O,CO和H2O浓度变化如图,则
在一体积为1L的密闭容器中,通入一定量的CO和H2O,在T1℃时发生如下反应:CO (g)+H2O(g)?CO2(g)+H2(g)△H<O,CO和H2O浓度变化如图,则| 时间(min) | CO | H2O | CO2 | H2 |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | C1 | C2 | C3 | C3 |
| 4 | C1 | C2 | C3 | C3 |
| 5 | 0.116 | 0.216 | 0.084 | C4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol强酸和1 mol强碱完全反应所放出的热量称为中和热 | |
| B. | 热化学方程式中表明的热量是指每摩尔反应物反应时吸收或放出的热量 | |
| C. | 1 mol碳燃烧所放出的热量为燃烧热 | |
| D. | 热化学方程式中的化学计量数表示物质的量,因此可用分数表示 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
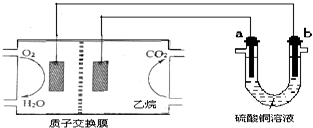
| A. | 燃料电池工作时,正极反应为O2+2H2O+4e-═4OH- | |
| B. | a极是铜,b极是铁时,硫酸铜溶液浓度减小 | |
| C. | a、b两极若是石墨,在同温同压下a极产生的气体与电池中消耗的乙烷体积的7/2 | |
| D. | a极是纯铜,b极是粗铜时,a极上有铜析出,b极逐渐溶解,两极质量变化相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径C>D>E | |
| B. | A2E6分子中各原子均满足8电子结构 | |
| C. | 气态氢化物的稳定性HmE>HnD | |
| D. | B、C形成的化合物中只可能存在离子键 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 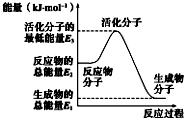 反应②中的能量变化如图所示,则△H2=E1-E3 | |
| B. | N2的燃烧热为180kJ•mol-1 | |
| C. | 由反应②知在温度一定的条件下,在一恒容密闭容器中通入1 mol N2和 3 mol H2,反应后放出的热量为Q1 kJ,若通入2 mol N2和 6 mol H2反应后放出的热量为Q2 kJ,则184.8>Q2>2Q1 | |
| D. | 氨的催化氧化反应为 4NH3(g)+5O2(g)═4NO(g)+6H2O(g)△H=+906 kJ•mol-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com