
 CH3OH(g)
CH3OH(g)  CH3OH(g) + H2O(g)
CH3OH(g) + H2O(g) | A��CuO | B��CuCO3���� | C��Cu(OH)2 | D��Cu2(OH)2CO3 |



 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
| ��ѧ�� | H��H | N��H | N��N |
| ����/kJ·mol��1 | 436 | 391 | 945 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 [Cu��NH3��3]Ac?CO��aq������H��0��
[Cu��NH3��3]Ac?CO��aq������H��0�� CH3OH��g��+H2O��g�� ��H����49.0kJ/mol
CH3OH��g��+H2O��g�� ��H����49.0kJ/mol CH3OH��g�� ��H<0
CH3OH��g�� ��H<0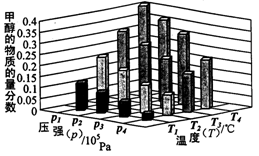
 CH3OCH3��g��+H2O��g�� ��H<0
CH3OCH3��g��+H2O��g�� ��H<0�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 ��
�� ��ʵ����N��N������Ϊ167kJ��mol��1�� NO2�е�������ƽ������Ϊ466 kJ��mol��1��N2O4�е�������ƽ������Ϊ438.5 kJ��mol��1��
��ʵ����N��N������Ϊ167kJ��mol��1�� NO2�е�������ƽ������Ϊ466 kJ��mol��1��N2O4�е�������ƽ������Ϊ438.5 kJ��mol��1�� 2NO2(g)�����¶�ΪT1��T2ʱ��ƽ����ϵ��NO2�����������ѹǿ�仯������ͼ��ʾ������˵����ȷ����
2NO2(g)�����¶�ΪT1��T2ʱ��ƽ����ϵ��NO2�����������ѹǿ�仯������ͼ��ʾ������˵����ȷ���� 
| ʱ�䣨s�� | 0 | 20 | 40 | 60 | 80 |
| n(NO2)/mol | 0.40 | n1 | 0.26 | n3 | n4 |
| n(N2O4)/mol | 0.00 | 0.050 | n2 | 0.080 | 0.080 |
 N2O4��ƽ�ⳣ��K�� �����������С�����䡱����
N2O4��ƽ�ⳣ��K�� �����������С�����䡱�����鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 2NO(g) ��H����֪�÷�Ӧ�� T ��ʱ��ƽ�ⳣ��K��9.0��
2NO(g) ��H����֪�÷�Ӧ�� T ��ʱ��ƽ�ⳣ��K��9.0�� 2NO2(g) ��H1 2NO2(g)
2NO2(g) ��H1 2NO2(g)  O2+2NO(g) ��H2 ��H= ���ú���H1����H2�ı���ʽ��ʾ����
O2+2NO(g) ��H2 ��H= ���ú���H1����H2�ı���ʽ��ʾ����| A������1 mol N2ͬʱ����1 mol O2 |
| B����������ܶȲ��� |
| C���������ƽ����Է����������� |
| D��2v��(N2)��v��(NO) |
 2NO(g)�ġ�K-T������c(NO)-t��ͼ����ͼA������֪�÷�ӦΪ ��Ӧ������ȡ����ȡ�������ͼB��֪����a��Ӧ��������ȣ�b�ı������������ ��
2NO(g)�ġ�K-T������c(NO)-t��ͼ����ͼA������֪�÷�ӦΪ ��Ӧ������ȡ����ȡ�������ͼB��֪����a��Ӧ��������ȣ�b�ı������������ ��
 2NO(g)________________(����ڻ�ѧƽ��״̬������������Ӧ������С������淴Ӧ������С�)��ƽ��ʱ��N2�ڻ�����������ٷ���Ϊ���٣����ڴ����д�����������̣��������2λ��Ч���֣�
2NO(g)________________(����ڻ�ѧƽ��״̬������������Ӧ������С������淴Ӧ������С�)��ƽ��ʱ��N2�ڻ�����������ٷ���Ϊ���٣����ڴ����д�����������̣��������2λ��Ч���֣��鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��Q1 +Q2 +Q3���������� | B��0��5��Q1 +Q2 +Q3�� |
| C��0��5Q1 �C0��5Q2 +0��5Q3������ | D��1��5Q1 �C0��5Q2 +0��5Q 3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������


 mol;
mol;

 ���>������<����=����
���>������<����=�����鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 3N2��2X��4H2O
3N2��2X��4H2O �鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com