
 CH3OH��g����H2O��g��
CH3OH��g����H2O��g��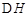 =-49��0kJ��mol
=-49��0kJ��mol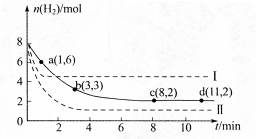
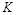 �����ߢ��Ӧ������ƽ�ⳣ��Ϊ
�����ߢ��Ӧ������ƽ�ⳣ��Ϊ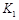 �����ߢ��Ӧ������ƽ�ⳣ��Ϊ
�����ߢ��Ӧ������ƽ�ⳣ��Ϊ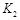 ����
����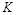 ��
��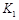 ��
��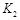 �Ĵ�С��ϵ�� ��
�Ĵ�С��ϵ�� ��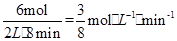 ����������֮�ȵ��ڼ�����֮��CO2��ƽ����Ӧ������0.125 mol��L-1��min-1
����������֮�ȵ��ڼ�����֮��CO2��ƽ����Ӧ������0.125 mol��L-1��min-1 CH3OH��g����H2O��g��
CH3OH��g����H2O��g�� =-49��0kJ��mol���ı�����������¶�ʹ����ƽ������ʱ�����̵�������ת�����½������ߢ�ı����������ѹǿʹ����ƽ������ʱ�����̣�����ƽ�������ƶ�����ԭƽ�����n��H2�����٣�Kֻ���¶��йأ�
=-49��0kJ��mol���ı�����������¶�ʹ����ƽ������ʱ�����̵�������ת�����½������ߢ�ı����������ѹǿʹ����ƽ������ʱ�����̣�����ƽ�������ƶ�����ԭƽ�����n��H2�����٣�Kֻ���¶��йأ� <0�ķ�Ӧ���¶�Խ�ߣ�KԽС������K1<K2=K��
<0�ķ�Ӧ���¶�Խ�ߣ�KԽС������K1<K2=K��


| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 CH3OH(g)��H2O(g)����H����49.0 kJ��mol��1�����H2��CH3OH(g)��Ũ����ʱ��仯���±���ʾ������˵������ȷ����(����)
CH3OH(g)��H2O(g)����H����49.0 kJ��mol��1�����H2��CH3OH(g)��Ũ����ʱ��仯���±���ʾ������˵������ȷ����(����)| ʱ��/min | c(H2)/mol��L��1 | c(CH3OH)/mol��L��1 | v(��)��v(��)�Ƚ� |
| t0 | 6 | 0 | �� |
| t1 | 3 | 1 | v(��)��v(��) |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��0.60mol��L | B��0.50mol��L | C��0.45mol��L | D��0.55mol��L |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 4NO+6H2O��2L���ܱ������н��У�����Ӻ�NO�����ʵ���������0.3mol����˷�Ӧ��ƽ������v (x)Ϊ�� ��
4NO+6H2O��2L���ܱ������н��У�����Ӻ�NO�����ʵ���������0.3mol����˷�Ӧ��ƽ������v (x)Ϊ�� ��| A��v��O2��=0.01mol/��L?s�� | B��v��NO��=0.01mol/��L?s�� |
| C��v��H2O��=0.006mol/��L?s�� | D��v��NH3��=0.005mol/��L?s�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 2Z(g)+2W(g)��2L�ܱ������н��У�5min��Y������0.5mol����˷�Ӧ������vΪ( )
2Z(g)+2W(g)��2L�ܱ������н��У�5min��Y������0.5mol����˷�Ӧ������vΪ( )| A��v(X)=0.05mol��L�C1��min�C1 | B��v(Z)=0.10mol��L�C1��min�C1 |
| C��v(Y)=0.10mol��L�C1��min�C1 | D��v(W)=0.05mol��L�C1��min�C1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 SO3(g)+NO(g) �ﵽƽ�⣬����Ӧ������ʱ��仯��ͼ��ʾ������ȷ�Ľ�����
SO3(g)+NO(g) �ﵽƽ�⣬����Ӧ������ʱ��仯��ͼ��ʾ������ȷ�Ľ�����
| A���淴Ӧ���ʣ�a��С�ڵ�c |
| B����Ӧ��Ũ�ȣ�a��С�ڵ�b |
| C����Ӧ��c��ʱSO2��ת������� |
| D����Ӧ�������������������������� |
�鿴�𰸺ͽ���>>
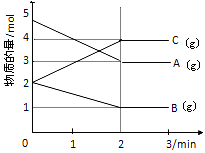
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 2C��g��,���� 2 s���룩����C ��Ũ��Ϊ 0.6 mol��L��1 ���� ������ A ��ʾ�ķ�Ӧ��ƽ������ �� 2 s ʱ���� B ��Ũ��Ϊ ��
2C��g��,���� 2 s���룩����C ��Ũ��Ϊ 0.6 mol��L��1 ���� ������ A ��ʾ�ķ�Ӧ��ƽ������ �� 2 s ʱ���� B ��Ũ��Ϊ ���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A����ѧ��Ӧ���ʿ���ijʱ������������ʵ�������ʾ |
| B����ѧ��Ӧ������ָһ��ʱ����,�κ�һ�ַ�Ӧ��Ũ�ȵļ��ٻ��κ�һ��������Ũ�ȵ����� |
| C�������κλ�ѧ��Ӧ��˵,��Ӧ����Խ��,��Ӧ�����Խ���� |
| D�����ݷ�Ӧ���ʵĴ�С��֪��ѧ��Ӧ���е���Կ��� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com