
A+、B+、C-、D、E五种粒子(分子或离子)中,每个粒子均有10个电子,已知:
①A++C-===D+E↑;②B++C-===2D。
请回答:
(1)C-离子的电子式是________________。
(2)A+离子中的键角为______________。
(3)分别写出A+和D反应、B+和E反应的离子方程式____________、____________。
(4)除D、E外,请再写出两种含10个电子的分子的分子式____________。
(5)除A+、B+外,请再写出两种含10个电子的阳离子________。
答案 (1)[ 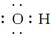 ]- (2)109°28′
]- (2)109°28′
(3)NH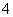 +H2O??NH3·H2O+H+ H3O++NH3===NH
+H2O??NH3·H2O+H+ H3O++NH3===NH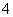 +H2O (4)CH4、Ne(答案合理即可)
+H2O (4)CH4、Ne(答案合理即可)
(5)Na+、Mg2+(答案合理即可)
解析 本题中五种粒子均有10个电子是解题的突破口。依据已有的元素与化合物知识可知,10电子的粒子中,原子有Ne;阴离子有N3-、O2-、F-、OH-、NH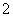 ,阳离子有Na+、Mg2+、Al3+、NH
,阳离子有Na+、Mg2+、Al3+、NH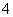 、H3O+;分子有CH4、NH3、H2O、HF。根据题意有:①A++C-===D+E↑,推知A+应为NH
、H3O+;分子有CH4、NH3、H2O、HF。根据题意有:①A++C-===D+E↑,推知A+应为NH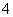 、C-为OH-、D为H2O、E为NH3,将其结果代入②B++C-===2D,推知B+应为H3O+。
、C-为OH-、D为H2O、E为NH3,将其结果代入②B++C-===2D,推知B+应为H3O+。


科目:高中化学 来源: 题型:
下列物质按熔点由高到低排列的顺序正确的是( )
A.NaCl、SiO2、CO2、Na B.Na、NaCl、CO2、SiO2
C.CO2、Na、NaCl、SiO2 D.SiO2、NaCl、Na、CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
焦亚硫酸钠(Na2S2O5)是常用的食品抗氧化剂之一。某研究小组进行如下实验:
实验一 焦亚硫酸钠的制取
采用下图装置(实验前已除尽装置内的空气)制取Na2S2O5。装置Ⅱ中有Na2S2O5晶体析出,发生的反应为Na2SO3+SO2===Na2S2O5。
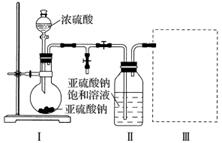
(1)装置Ⅰ中产生气体的化学方程式为__________________________________________。
(2)要从装置Ⅱ中获得已析出的晶体,可采取的分离方法是________________________________________________________________________
________________________________________________________________________。
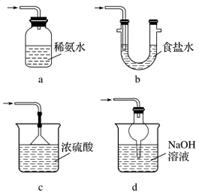
(3)装置Ⅲ用于处理尾气,可选用的最合理装置(夹持仪器已略去)为__________(填序号)。
实验二 焦亚硫酸钠的性质
Na2S2O5溶于水即生成NaHSO3。
(4)证明NaHSO3溶液中HSO 的电离程度大于水解程度,可采用的实验方法是_____(填序号)。
的电离程度大于水解程度,可采用的实验方法是_____(填序号)。
a.测定溶液的pH
b.加入Ba(OH)2溶液
c.加入盐酸
d.加入品红溶液
e.用蓝色石蕊试纸检测
(5)检验Na2S2O5晶体在空气中已被氧化的实验方案是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知阴离子R2-的原子核内有n个中子,R原子的质量数为m,则ω g R原子完全转化为R2-时,含有电子的物质的量是 ( )
A.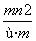 mol B.
mol B.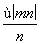 mol
mol
C.ω(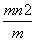 ) mol D.
) mol D.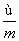 (m-n+2) mol
(m-n+2) mol
查看答案和解析>>
科目:高中化学 来源: 题型:
下图为几种粒子的结构示意图,完成以下填空。
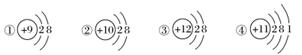
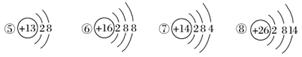
(1)属于阳离子结构的粒子是________(填编号,下同)。
(2)具有稳定性结构的原子是__________________。
(3)只能得电子的粒子是______________;只能失电子的粒子是______________;既能得电子,又能失电子的粒子是____________________________。
(4)③粒子半径________④粒子半径(填“大于”、“小于”或“等于”)。
(5)某元素R形成的氧化物为R2O3,则R的离子结构示意图可能是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
短周期元素W、X、Y、Z的原子序数依次增大,其简单离子都能破坏水的电离平衡的是( )
A.W2-、X+ B.X+、Y3+
C.Y3+、Z2- D.X+、Z2-
查看答案和解析>>
科目:高中化学 来源: 题型:
X和Y均为短周期元素,X原子的最外层电子数是次外层电子数的2.5倍,Y位于X的前一周期,且最外层只有一个电子,则X和Y形成的化合物的分子式可表示为 ( )
A.XY B.XY2
C.XY3 D.XY4
查看答案和解析>>
科目:高中化学 来源: 题型:
氮氧化合物(用NOx表示)是大气污染的重要因素,根据NOx的性质特点,开发出多种化学治理氮氧化合物污染的方法。
(1)用氨可将氮氧化物转化为无毒气体。已知:4NH3+6NO 5N2+6H2O,8NH3+6NO2
5N2+6H2O,8NH3+6NO2 7N2+12H2O。同温同压下,3.5 L NH3恰好将3.0 L NO和NO2的混合气体完全转化为N2,则原混合气体中NO和NO2的体积之比是________。
7N2+12H2O。同温同压下,3.5 L NH3恰好将3.0 L NO和NO2的混合气体完全转化为N2,则原混合气体中NO和NO2的体积之比是________。
(2)工业尾气中氮的氧化物常采用碱液吸收法处理。
①NO2被烧碱溶液吸收时,生成两种钠盐,其物质的量之比1∶1,写出该反应的化学方程式:________________。
②NO与NO2按物质的量之比1∶1被足量NaOH溶液完全吸收后只得到一种钠盐,该钠盐的化学式是______。
(3)纯碱溶液也能用于处理氮氧化合物废气,反应原理与上述(2)类似,同时产生CO2。
①请写出纯碱溶液吸收NO2的化学方程式:________。
②现有一定量的某工业废气,其中含有3.36 L NO2、1.12 L NO(已换算为标准状况,假设不含N2O4),恰好被200 mL碳酸钠溶液吸收,所得盐的物质的量分别为________、________,该碳酸钠溶液的物质的量浓度为____________mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验中,所选装置不合理的是( )


A.分离Na2CO3溶液和CH3COOC2H5,选④
B.用CCl4提取碘水中的碘,选③
C.用FeCl2溶液吸收Cl2选⑤
D.粗盐提纯,选①和②
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com