
【题目】根据要求回答:
(1)下列各图中,表示反应是吸热反应的是_______

(2)到目前为止,由化学能转变的热能或电能仍然是人类使用的最主要的能源。在25 ℃、101 kPa下,16 g的甲醇(CH3OH)完全燃烧生成CO2和液态水时放出352 kJ的热量,则表示甲醇燃烧的热化学方程式为_____________________________。
(3)化学反应中放出的热能(焓变,ΔH)与反应物和生成物的键能(E)有关。
已知:H2(g)+Cl2(g)===2HCl(g) ΔH=-185 kJ·mol-1
E(H—H)=436 kJ·mol-1
E(Cl—Cl)=243 kJ·mol-1
则E(H—Cl)=________________________________。
(4)已知:
甲醇脱水反应 2CH3OH(g)=CH3OCH3(g)+H2O(g)△H1=-23.9KJ·mol-1
甲醇制烯烃反应 2CH3OH(g)=C2H4(g)+2H2O(g)△H2=-29.1KJ·mol-1
乙醇异构化反应 CH3CH2OH(g)=CH3OCH3(g)△H3=+50.7KJ·mol-1
则乙烯气相直接水合反应C2H4(g)+H2O(g)=C2H5OH(g)的△H=____________kJ·mol-1
【答案】ACH3OH(g)+3/2O2(g)=CO2(g)+2H2O(l)△H=-704kJ·mol-1432kJ·mol-1-45.5
【解析】
分析: 化学反应都伴随着能量变化,通常表现为热量变化。当反应物所具有的总能量大于生成物所具有的总能量时,反应物转化为生成物的过程中,反应体系就会向环境放出热量,这是放热反应;反之如果反应物具有的总能量小于生成物所具有的总能量时,反应物需要吸收环境的能量才能转化为生成物,这就是吸热反应;依据燃烧热概念是1mol可燃物完全燃烧生成稳定氧化物放出的热量,结合热化学方程式书写方法,标注物质聚集状态和对应焓变;反应热=反应物总键能-生成物总键能,据此计算;根据盖斯定律计算反应热。
(1)图示可知,A反应过程中反应物总能量低于生成物总能量,B、D反应过程中反应物总能量高于生成物总能量,C反应过程中反应物总能量等于生成物总能量,因此只有A反应过程中的正反应是吸热反应。
(2)16g的甲醇完全燃烧生成CO2和液态水时放出352kJ的热量,32g甲醇即1mol,燃烧生成二氧化碳和液态水放热704kJ,则热化学方程式为:CH3OH(g)+3/2O2(g)=CO2(g)+2H2O(l) △H=-704kJ·mol-1 ;
(3)H2(g)+Cl2(g)═2HCl(g) △ H=-185kJ/mol,E(H-H)=436kJ/mol,E(Cl-Cl)=243kJ/mol,△ H=反应物键能总和-生成物键能总和得到:-185kJ/mol=436kJ/mol+243kJ/mol-2E(H-Cl),则E(H-Cl)=432kJ/mol;
(4)①2CH3OH(g)=CH3OCH3(g)+H2O(g)△H1=-23.9 kJ/mol
②2CH3OH(g)=C2H4(g)+2H2O(g)△H2=-29.1 kJ/mol
③CH3CH2OH(g)=CH3OCH3(g)△H3=+50.7 kJ/mol根据盖斯定律①-②-③可得:C2H4(g)+H2O(g)=C2H5OH(g)△H=-23.9 kJ/mol +29.1 kJ/mol -50.7 kJ/mol =-45.5kJ/mol。故答案为:-45.5。


 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】氮及其化合物广泛存在于自然界中。回答下列问题:
(1)写出N原子的电子排布式_____________。在基态14N原子中,核外存在___________个未成对电子。
(2)原子第一电离能是指气态电中性基态原子失去一个电子转化为气态基态正离子所需要的最低能量,C、N、O原子的第一电离能由大到小的顺序为_______________。
(3)氮气和氢气在一定条件下可合成氨,氨分子中氮原子的杂化方式为_____________杂化。
(4)纯叠氮酸HN3在常温下是一种液体,沸点较高,为308.8K,主要原因是_________。
(5)X的+1价阳离子中所有电子正好充满K、L、M三个电子层,它与N3-形成的晶体结构如图所示。X的元素符号是________,X离子与N3-形成的化合物化学式为____________。

(6)假设X+的半径为a cm,N3-的半径为b cm,且X+与N3-都是紧密接触的刚性小球,则该氮化物的密度为_____________g.cm-3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上以铬铁矿(主要成分为FeO和Cr2O3,含有Al2O3、SiO2等杂质)为主要原料生产化工原料红矾钠(主要成分为:Na2Cr2O7·2H2O),其主要工艺流程如下:

查阅相关资料得知:
i.常温下,NaBiO3不溶于水,有强氧化性,在碱性条件下能将Cr3+转化为CrO42-,自身被还原为Bi(OH)3固体。
ii.
物质 | 开始沉淀的pH | 完全沉淀的pH |
Fe(OH)3 | 2.7 | 3.7 |
Al(OH)3 | 3.4 | 4.4 |
Cr(OH)3 | 4.6 | 5.9 |
Fe(OH)2 | 7.5 | 9.7 |
Bi(OH)3 | 0.7 | 4.5 |

回答下列问题:
(1)将铬铁矿矿石粉碎的目的是________________________________________。
(2)操作I、III、IV用到的主要玻璃仪器有玻璃棒和___________(填仪器名称)。
(3)写出④反应的化学方程式_____________________________________________。
(4)⑤中酸化是使CrO42-转化为Cr2O72-![]() 写出该反应的离子方程式______。
写出该反应的离子方程式______。
(5)将溶液H经下列操作:蒸发浓缩,__________,过滤,洗涤,干燥即得红矾钠。
(6)取一定质量的固体D溶解于200 mL的稀硫酸中,向所得溶液中加入5.0 mol/L的NaOH溶液,生成沉淀的物质的量(n)与加入NaOH溶液的体积(V)关系如图所示,则稀硫酸的浓度为_________,固体D中含Fe化合物的物质的量为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实际存在的11H、21H、31H 、 H+和H2,它们是( )
A. 氢的五种同位素 B. 五种氢元素
C. 氢的五种核素 D. 氢元素的五种不同微粒
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2S有剧毒,石油化工中常用以下方法处理石油炼制过程中产生的H2S废气。先将含H2S的废气(其它成分不参与反应)通入FeCl3溶液中,过滤后将溶液加入到以铁和石墨棒为电极的电解槽中电解(如下图所示),电解后的溶液可以循环利用。下列有关说法不正确的是

A. 过滤所得到沉淀的成分为S和FeS
B. 与外接电源a极相连的电极反应为Fe2+-e-=Fe3+
C. 与外接电源b极相连的是铁电极
D. 若有0.20mol的电子转移,得到氢气2.24L(标准状况)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应:H2(g)+![]() O2(g)=H2O(g) △H1
O2(g)=H2O(g) △H1
![]() N2(g)+O2(g)=NO2(g) △H2
N2(g)+O2(g)=NO2(g) △H2
![]() N2(g)+
N2(g)+![]() H2(g)=NH3(g) △H3
H2(g)=NH3(g) △H3
则反应2NH3(g)+![]() O2(g)=2NO2(g)+3H2O(g)的△H为
O2(g)=2NO2(g)+3H2O(g)的△H为
A. 2△H1+2△H2-2△H3 B. △H1+△H2-△H3
C. 3△H1+2△H2+2△H3 D. 3△H1+2△H2-2△H3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解NaB(OH)4溶液制备H3BO3的原理如下图所示,下列叙述错误的是

A. M室发生的电极反应式:2H2O-4e-=O2↑+4H+
B. a、c为阴离子交换膜,b为阳离子交换膜
C. N室中:a%<b%
D. 理论上每生成1 mol H3BO3,两极室共产生标准状况下16.8 L气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学变化中伴随着能量的转化,在理论研究和生产生活中有很重要的作用。
Ⅰ.催化剂是化工技术的核心,绝大多数的化工生产均需采用催化工艺。

(1)人们常用催化剂来选择反应进行的方向.图1所示为一定条件下1 mol CH3OH 与O2发生反应时.生成CO、CO2或HCHO的能量变化图[反应物O2(g)和生成物H2O(g)略去]。在有催化剂作用下,CH3OH与O2反应主要生成________(填“CO”、“CO2”或“HCHO”);2HCHO(g)+O2(g)=2CO(g)+2H2O(g) △H=________。
Ⅱ.第三代混合动力车,可以用电动机,内燃机或二者结合推动车辆。汽车上坡或加速时,电动机提供推动力,降低汽油的消耗;在刹车或下坡时,电池处于充电状态。
(2)混合动力车的内燃机以汽油为燃料,汽油(以辛烷C8H18计)和氧气充分反应,生成1 mol 水蒸气放热550kJ;若1 g水蒸气转化为液态水放热2.5kJ,则辛烷燃烧热的热化学方程式为_____________。

(3)混合动力车目前一般使用镍氢电池,该电池中镍的化合物为正极,储氢金属(以M表示)为负极,碱液(主要为KOH)为电解质溶液。镍氢电池充放电原理示意如图,其总反应式为: H2+2NiOOH![]() 2Ni(OH)2。
2Ni(OH)2。
根据所给信息判断,混合动力车上坡或加速时.乙电极周围溶液的pH______(填“增大”,“减小”或“不变”),该电极的电极反应式为_______________。
(4)远洋轮船的钢铁船体在海水中易发生电化学有腐蚀中的______腐蚀。为防止这种腐蚀,通常把船体与浸在海水里的Zn块相连,或与像铅酸蓄电池这样的直流电源的______(填“正”或“负”)极相连。
Ⅲ.A、B、C三种强电解质,它们在水中电离出的离子如表所示:
阳离子 | Ag+ Na+ |
阴离子 | NO3- SO42 - Cl- |
如图1所示的装置中,甲、乙、丙三个烧杯依次分别盛放足量的A、B、C三种溶液。电极均为石墨电极。接通电源,经过一段时间后,测得乙中c电极质量增加了27克。常温下各烧杯中溶液的pH与电解时间t的关系图如图2所示。据此回答下列问题:
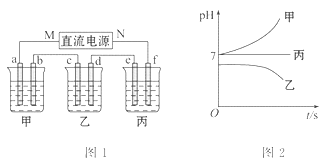
(5)M为电源的______极(填写“正”或“负”),甲为__________(填写化学式)。
(6)计算电极f上生成的气体在标准状况下的体积_________。
(7)写出乙烧杯中的电解池反应______________________。
(8)若电解后甲溶液的体积为25 L,则该溶液的pH为_______。
(9)要使丙恢复到原来的状态,应加入_______g______。(填写化学式)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的化学式与其名称不相符的是( )
A.磁性氧化铁:Fe2O3B.明矾:KAl(SO4)2·12H2O
C.纯碱:Na2CO3D.原硅酸:H4SiO4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com