
| 编号 | T/K | 锌规格 | 盐酸浓度/mol•L-1 | 实验目的 |
| ① | 298 | 粗颗粒 | 2.00 | (Ⅰ)实验①和②探究盐酸浓度对该反应速率的影响; (Ⅱ)实验①和③探究温度对该反应速率的影响; (Ⅲ)实验①和④探究锌规格(粗、细)对该反应速率的影响. |
| ② | 298 | |||
| ③ | 308 | |||
| ④ | 298 |
| 时间(S) | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 | 100 |
| 氢气体积 (ml) | 16.8 | 39.2 | 67.2 | 224 | 420 | 492.8 | 520.8 | 543.2 | 554.4 | 560 |
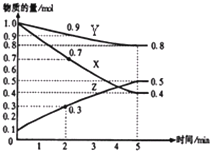
分析 (1)根据实验的目的和影响化学反应速率的因素来设计实验,注意对照实验的设计是关键,采用控制变量法来比较外界条件对反应速率的影响;
(2)①计算氢气的平均反应速率v(H2),根据反应速率之比等于方程式的系数之比计算用盐酸表示的速率;
②根据相等时间段内,产生的氢气的体积越大,可以确定反应速率越快,据影响反应速率的因素来判断;
③根据相等时间段内,产生的氢气的体积越小,可以确定反应速率越慢,据影响反应速率的因素来判断;
(3)根据浓度以及原电池原理的应用来确定化学反应速率的变化情况;
(4)根据物质的量的变化判断反应物和生成物,根据物质的量的变化之比等于化学计量数之比书写方程式;
(5)①定性分析:根据反应生成气体的快慢分析;
②定量分析:该反应是通过反应速率分析的,所以根据v=$\frac{△V}{△t}$判断.
解答 解:(1)(Ⅰ)由实验目的可知,探究浓度、温度、接触面积对化学反应速率的影响,实验①②探究盐酸浓度对该反应速率的影响,所以固体的表面积应该是不同的,实验①是粗颗粒,但是实验②是细颗粒;
(Ⅱ)探究温度对该反应速率的影响,则固体的表面积以及盐酸的浓度应该是一样的,所以实验③应该是粗颗粒的固体,盐酸的浓度选择2.00;
(Ⅲ)探究锌规格(粗、细)对该反应速率的影响,要求试验温度以及盐酸的浓度是相等的,实验①盐酸浓度是2.00,所以实验④应该是细颗粒,盐酸浓度是2.00;
故答案为:
| 编号 | T/K | 锌规格 | 盐酸浓度/mol•L-1 | 实验目的 |
| ① | 298 | 粗颗粒 | 2.00 | ③ ④ |
| ② | 298 | 粗颗粒 | 2.00 | |
| ③ | 308 | 粗颗粒 | 2.00 | |
| ④ | 298 | 细颗粒 | 2.00 |
点评 本题考查化学反应速率的影响因素及反应速率的计算,注意信息中提高的条件及图象的分析是解答的关键,较好的考查学生综合应用知识的能力.


科目:高中化学 来源: 题型:解答题
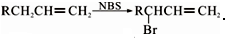 .醇酸树脂是一种成膜性良好的树脂,下面是一种醇酸树脂的合成线路:
.醇酸树脂是一种成膜性良好的树脂,下面是一种醇酸树脂的合成线路: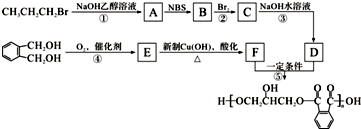
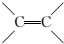 ,C的名称是1,2,3-三溴丙烷.
,C的名称是1,2,3-三溴丙烷.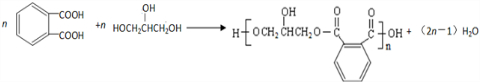 .
.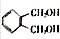 的同分异构体中同时符合下列条件的芳香族化合物共有6种.
的同分异构体中同时符合下列条件的芳香族化合物共有6种.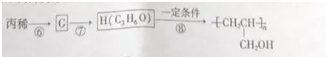
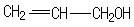 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
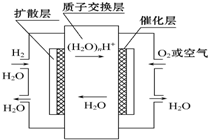
| A. | 正极通入H2,发生还原反应 | |
| B. | 负极通入H2,发生还原反应 | |
| C. | 导电离子为质子,且在电池内部由正极定向移向负极 | |
| D. | 总反应式为2H2+O2=2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ | ⑩ |
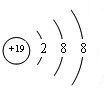 .元素⑩名称为溴,在周期表中的位置是第四周期ⅦA族.
.元素⑩名称为溴,在周期表中的位置是第四周期ⅦA族.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 煤经分馏得到了煤焦油,从中可分离出苯、甲苯、二甲苯等有机化合物 | |
| B. | 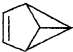 的一氯代物有3种 的一氯代物有3种 | |
| C. | 若两种二肽互为同分异构体,则二者的水解产物一定不相同 | |
| D. | 木糖醇(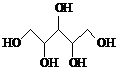 )和葡萄糖( )和葡萄糖(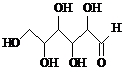 ),互为同系物,均属于糖类 ),互为同系物,均属于糖类 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
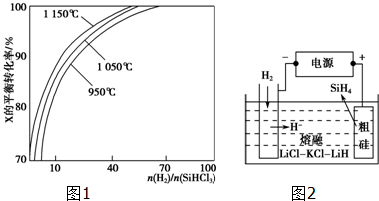
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com