
���ֶ�����Ԫ�ص�ԭ�Ӱ뾶���������ϼ����±���
| Ԫ�ش��� | Z | M | Q | R | T | X |
| ԭ�Ӱ뾶��nm | 0.077 | 0.130 | 0.111 | 0.099 | 0.073 | 0.102 |
| �������ϼ� | +4 ,-4 | +2 | +4 ,-4 | ��1,+7 | ��2 | +6����2 |
 (���ȶ����ȶ�)��
(���ȶ����ȶ�)�� �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��2013?����һģ���±���ʾΪ���ֶ�����Ԫ�ص�ԭ�Ӱ뾶����Ҫ���ϼۣ����ݱ�����Ϣ�ж�����������ȷ���ǣ�������
|
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| Ԫ�ش��� | W | R | X | Y | Z | Q | M |
| ԭ�Ӱ뾶/nm | 0.037 | 0.186 | 0.074 | 0.075 | 0.077 | 0.110 | 0.160 |
| ��Ҫ���ϼ� | +1 | +1 | -2 | -3��+5 | +2��+4 | -3��+5 | +2 |
| ||
| ||
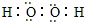
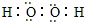
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�����±��в��ֶ�����Ԫ�ص�ԭ�Ӱ뾶����Ҫ���ϼ��жϣ�����������ȷ���ǣ�������
|
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| Ԫ�ش��� | W | R | X | Y | Z | Q | M |
| ԭ�Ӱ뾶/nm | 0.037 | 0.186 | 0.074 | 0.075 | 0.077 | 0.110 | 0.160 |
| ��Ҫ���ϼ� | +1 | +1 | -2 | -3��+5 | +2��+4 | -3��+5 | +2 |
| ||
| ||
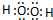
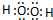
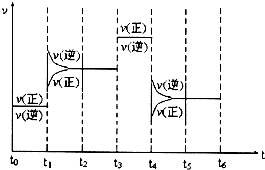
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| Ԫ�ش��� | W | R | X | Y | Z | Q | M |
| ԭ�Ӱ뾶/nm | 0.037 | 0.186 | 0.074 | 0.075 | 0.077 | 0.110 | 0.143 |
| ��Ҫ���ϼ� | +1 | +1 | -2 | +5��-3 | +4��-4 | +5��-3 | +3 |


�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com