
【题目】氮是地球上含量丰富的元素,氮及其化合物的研究在生产、生活有着重要意义。
(1)下图是1 mol NO2和1 mol CO反应生成CO2和NO过程中能量变化示意图,写出NO2和CO反应的热化学方程式。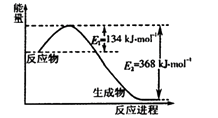
(2)已知:
N2(g)+O2(g)=2 NO(g) △H=+180 kJ·mol-1
2NO(g)+2 CO(g)=N2(g)+2 CO2(g)△H=-746 kJ·mol-1
则反应CO(g)+1/2O2(g)=CO2(g)的△H=kJ·mol-1。
(3)在一固定容积为2L的密闭容器内加人0.2 mol的N2和0.6 mol的H2 , 在一定条件下发生如下反应。N2(g)+3H2(g) ![]() 2NH3(g)△H<0,若第5min时达到平衡,此时测得NH3的物质的量为0.2mol,则前5min的平均反应速率v(N2)为 , 平衡时H2的转化率为 , 该反应的平衡常数K=(计算结果保留一位小数)。
2NH3(g)△H<0,若第5min时达到平衡,此时测得NH3的物质的量为0.2mol,则前5min的平均反应速率v(N2)为 , 平衡时H2的转化率为 , 该反应的平衡常数K=(计算结果保留一位小数)。
(4)在固定体积的密闭容器中,1.0×103kPa时,反应N2(g)+3H2(g) ![]() 2NH3(g) △H <0的平衡常数K与温度T的关系如下表:则K1K2(填写“>”、“=”或“<”)
2NH3(g) △H <0的平衡常数K与温度T的关系如下表:则K1K2(填写“>”、“=”或“<”)
T/K | 298 | 398 | 498 |
平衡常数K | 51 | K1 | K2 |
(5)在体积一定的密闭容器中能说明合成氨反应一定达到平衡状态的是(填字母)
a.容器内N2、H2、NH3的浓度之比为1︰3︰2
b.NH3的浓度保持不变
c.容器内压强保持不变
d.混合气体的密度保持不变
【答案】
(1)NO2(g)+CO(g)= CO2(g)+NO(g) △H = -234 kJ·mol-1
(2)-283
(3)0.01 molL-1min-1;50%;59.3
(4)>
(5)b c
【解析】(1)该反应的焓变△H=E1-E2=134KJ/mol-368KJ/mol=-234KJ/mol,所以热化学方程式为:NO2(g)+CO(g)═NO(g)+CO2(g)△H=-234kJmol-1;
(2)已知:①N2(g)+O2(g)=2NO(g)△H=+180kJmol-1②2NO(g)+2CO(g)=N2(g)+2CO2(g)△H=-746kJmol-1 , 利用盖斯定律将①× ![]() +②×
+②× ![]() 可得CO(g)+
可得CO(g)+ ![]() O2(g)=CO2(g)△H=
O2(g)=CO2(g)△H= ![]() ×[+180kJmol-1+(-746kJmol-1)]=-283Jmol-1;
×[+180kJmol-1+(-746kJmol-1)]=-283Jmol-1;
(3)
N2(g)+ | 3H2(g) | 2NH3(g) | |
起始(mol/L) | 0.1 | 0.3 | 0 |
转化(mol/L) | 0.05 | 0.15 | 0.1 |
平衡(mol/L) | 0.05 | 0.15 | 0.1 |
第5分钟时达到平衡,测得NH3的物质的量为0.2mol,所以减小的氮气物质的量为0.1mol,v(N2)= ![]() =
= ![]() =0.01mol/(Lmin),平衡时H2的转化率为
=0.01mol/(Lmin),平衡时H2的转化率为 ![]() ×100%=50%,该反应的平衡常数K=
×100%=50%,该反应的平衡常数K= ![]() =59.3;
=59.3;
(4)反应为放热反应,生成温度平衡向逆反应方向移动,平衡常数减小,则K1>K2;
(5)a.容器内N2、H2、NH3的浓度之比为1:3:2,不能说明达到判断状态,取决于起始配料比和转化程度,a不符合题意;
b.NH3的浓度保持不变,可说明达到平衡状态,b符合题意;
c.容器内压强保持不变,可说明达到平衡状态,c符合题意;
d.因体积不变,质量不变,则混合气体的密度保持不变,不能达到平衡状态,d不符合题意;
所以答案是:(1)NO2(g)+CO(g)═NO(g)+CO2(g)△H=-234kJmol-1;(2)-283;(3)0.01 mol/(Lmin);50%;59.3;(4)>;(5)bc
【考点精析】关于本题考查的反应速率的定量表示方法和化学平衡状态的判断,需要了解反应速率的单位:mol/(L·min)或mol/(L·s) v=△c-△t;状态判断:①v(B耗)=v(B生)②v(C耗):v(D生)=x : y③c(C)、C%、n(C)%等不变④若A、B、C、D为气体,且m+n≠x+y,压强恒定⑤体系颜色不变⑥单位时间内某物质内化学键的断裂量等于形成量⑦体系平均式量恒定(m+n ≠ x+y)等才能得出正确答案.


 小学课时作业全通练案系列答案
小学课时作业全通练案系列答案 金版课堂课时训练系列答案
金版课堂课时训练系列答案 单元全能练考卷系列答案
单元全能练考卷系列答案 新黄冈兵法密卷系列答案
新黄冈兵法密卷系列答案科目:高中化学 来源: 题型:
【题目】(I)LiH可作飞船的燃料,已知下列反应:
①2Li(s)+H2(g)===2LiH(s) ΔH=-182 kJ·mol-1;
②2H2(g)+O2(g)===2H2O(l) ΔH=-572 kJ·mol-1;
③4Li(s)+O2(g)===2Li2O(s) ΔH=-1196 kJ·mol-1。
试写出LiH在O2中燃烧的热化学方程式:__________________________________________。
(II)利用H2和CO2生产甲醇。某温度下,在容积为2L的密闭容器中充入1molCO2和3.25mol H2,在一定条件下反应,测得CO2、CH3OH(g)和H2O(g)的物质的量(n)随时间的变化关系如图所示。
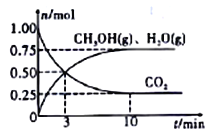
(1)从反应开始到3min时,氢气的平均反应速率v(H2)=____________。
(2)下列措施中一定能使CO2的转化率增大的是_______________(填序号)。
A.在原容器中再充入1mol CO2 B.在原容器中再充入1mol H2
C.在原容器中再充入1mol He D.使用更有效的催化剂
E. 缩小容器的容积 F. 将水蒸气从体系中分离出
(III)图是甲醇燃料电池工作的示意图,其中A、B、D均为石墨电极,C为铜电极。工作一段时间后,断开K,此时A、B两极上产生的气体体积相同。
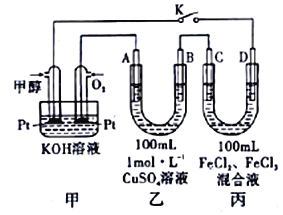
(1)甲中负极的电极反应式为_______________________________。
(2)乙中A极析出的气体在标准状况下的体积为_______________________。
(IV)已知常温下CN-的水解常数Kb=1.61×10-5。
(1)常温下,含等物质的量浓度的HCN与NaCN的混合溶液显_________(填“酸”“碱”或“中”)性,c(CN-)_______(填“>”“<”或“=”)c(HCN)。
(2)常温下,若将c molL-1盐酸与0.61 molL-1KCN溶液等体积混合后恰好得到中性溶液,则c=________(小数点后保留4位数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜及其化合物在生活、生产中有广泛应用。
(1)常用胆矾溶液对游泳池中的水消毒,它的水溶液呈酸性,用离子方程式表示其原因:________________________________________________________________________________。
(2)在Cu(OH)2悬浊液中滴加氨水,蓝色沉定变成蓝色溶液。已知:Ksp[Cu(OH)2]=2.2×10-20,Cu2+(aq)+4NH3(aq)![]() [Cu(NH3)4]2+(aq)K1=2.0×1013。则
[Cu(NH3)4]2+(aq)K1=2.0×1013。则
Cu(OH)2(s)+4NH3(aq)![]() [Cu(NH3)4]2+(aq)+2OH-(aq)K2=_____________。
[Cu(NH3)4]2+(aq)+2OH-(aq)K2=_____________。
(3)Cu(OH)2溶于浓烧碱溶液生成Na2CuO2,在Na2CuO2溶液中滴加CuCl2溶液,可能观察到的现象是______________________________________________________________________________。
(4)纳米级氧化亚铜(Cu2O)常作催化剂。工业上可用电解法制备,装置如图所示。
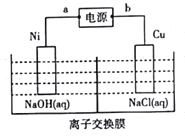
①a极名称是_________________;阳极的反应式为___________________。
②若电解过程中有1mol离子通过交换膜,则制备Cu2O的质量为_____________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,将2 mol A和3 mol B充入一密闭容器中,发生反应:aA(g)+B(g) ![]() C(g)+D(g),5 min后达到平衡.已知该温度下其平衡常数K=1,若温度不变时将容器的体积扩大为原来的10倍,A的转化率不发生变化,则( )
C(g)+D(g),5 min后达到平衡.已知该温度下其平衡常数K=1,若温度不变时将容器的体积扩大为原来的10倍,A的转化率不发生变化,则( )
A.a=3
B.a=2
C.B的转化率为40%
D.B的转化率为60%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用特殊方法把固体物质加工到纳米级(1nm—100nm)的超细粉末粒子,然后制得纳米材料。下列分散质粒子直径具有与此相同数量级的是( )
A.淀粉溶液B.泥水C.酒精D.硫酸铜溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】证明可逆反应N2(g)+3H2(g)![]() 2NH3(g)已达到平衡状态的是( )
2NH3(g)已达到平衡状态的是( )
①6个N—H键形成的同时,有3个H—H键断裂;②3个H—H键断裂的同时,有6个N—H键断裂;③其他条件不变时,混合气体平均相对分子质量不再改变;④保持其他条件不变时,体系压强不再改变;⑤NH3、N2、H2的体积分数都不再改变;⑥恒温恒容时,密度保持不变;⑦3v(N2)正 =v(H2)逆;⑧容器内A、B、C、D四者共存 ⑨NH3的生成速率与分解速率相等; ⑩A 、B、C的分子数目比为1:3:2。
A. 全部 B. ①③④⑤⑧ C. ②③④⑤⑦⑨ D. ①③⑤⑥⑦⑩
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,在2L密闭容器中气态物质X和Y反应生成气态物质Z,它们的物质的量随时间的变化如表所示。
(1)根据左表中数据,在图中画出X、Y、Z的物质的量(n)随时间(t)变化的曲线:
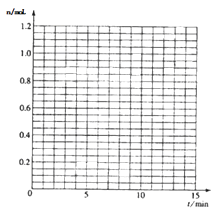
(2)体系中发生反应的化学方程式是;
(3)列式计算该反应在0-3min时间内产物Z的平均反应速率;
(4)该反应达到平衡时反应物X的转化率α等于;
(5)如果该反应是放热反应。改变实验条件(温度、压强、催化剂)得到Z随时间变化的曲线①、②、③(如下图所示)。则曲线①、②、③所对应的实验条件改变分别是:① ②③。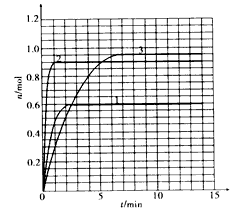
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应CH2=CH2+ H2→CH3-CH3 , 有关化学键的键能如下: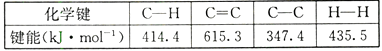
则该反应的反应热△H为( )
A.+288.8kJ/mo1
B.-703.4 kJ/mo1
C.+125.4kJ/mo1
D.-125.4 kJ/mo1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
(1)I.已知:Na2S2O3 + H2 SO4=Na2SO4 + SO2↑+S↓+H2O,某同学探究影响硫代硫酸钠与稀硫酸反应速率的因素时,设计了如下系列实验:
实验序号 | 反应温度/℃ | Na2S2O3溶液 | 稀H2SO4 | H2O | ||
V/mL | c/(mol/L) | V/mL | c/(mol/L) | V/mL | ||
① | 20 | 10.0 | 0.10 | 10.0 | 0.50 | 0 |
② | 40 | V1 | 0.10 | V2 | 0.50 | V3 |
③ | 20 | V4 | 0.10 | 4.0 | 0.50 | V5 |
①该实验①、②可探究温度对反应速率的影响,因此V1= , V2 = , V3=;
(2)②若V4=10.0,V5=6.0,则实验①、③可探究 对反应速率的影响。
(3)Ⅱ.利用反应:I2+2Na2S2O3=Na2S4O6+2NaI可定量测定硫代硫酸钠(Mr=158)的纯度,现在称取wg硫代硫酸钠固体样品,配成250 mL的溶液,取25.00 mL置于锥形瓶中,加入指示剂,用a mol/L的碘水滴定,消耗碘水b mL,则:
①滴定应选择的指示剂是 , 滴定终点的现象为。
②对于该滴定实验的有关操作或误差分析正确的是。
A.滴定前,要用对应装入的溶液润洗滴定管和锥形瓶
B.滴定过程中,标准液滴到锥形瓶外,会使所测得的结果偏大
C.滴定开始时滴定管尖嘴有气泡,滴定结束后气泡消失,测得纯度将偏小
D.滴定前仰视读数而滴定结束时俯视读数,则所测得的纯度将会偏小
③样品中硫代硫酸钠纯度的表达式为。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com