
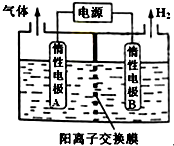
 利用LiOH可制备锂离子电池正极材料.LiOH可由电解法制备,如图,两极区电解质溶液分别为LiOH和LiCl溶液.下列说法错误的是( )
利用LiOH可制备锂离子电池正极材料.LiOH可由电解法制备,如图,两极区电解质溶液分别为LiOH和LiCl溶液.下列说法错误的是( )| A. | B极区电解质溶液为LiOH溶液 | |
| B. | 阳极电极反应式为2Cl--2e-═Cl2↑ | |
| C. | 电解过程中主要是H+通过阳离子交换膜向B电极迁移 | |
| D. | 电极A连接电源的正极 |
分析 电解制备LiOH,两电极区电解液分别为LiOH和LiCl溶液,由图可知,右侧生成氢气,则B中氢离子放电,可知B为阴极,在B中制备LiOH,Li+由A经过阳离子交换膜向B移动;A中为LiCl溶液,氯离子放电生成氯气,根据电解池的工作原理来回答.
解答 解:电解制备LiOH,两电极区电解液分别为LiOH和LiCl溶液,由图可知,右侧生成氢气,则B中氢离子放电,可知B为阴极,在B中制备LiOH.
A、A中为LiCl溶液,B极区电解质溶液为LiOH溶液,故A正确;
B、由图可知,右侧生成氢气,则B中氢离子放电,可知B为阴极,A中为LiCl溶液,氯离子放电生成氯气,阳极电极反应式为2Cl--2e-═Cl2↑,故B正确;
C、B为阴极,A是阳极,电解过程中,电解质中的阳离子移向阴极,H+通过阳离子交换膜向B电极迁移,同时Li+由A经过阳离子交换膜向B移动,故C错误;
D、A是阳极,A连接电源的正极,故D正确.
故选C.
点评 本题考查学生电解池的工作原理以及应用方面的知识,属于综合知识的考查,难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 冰醋酸与NaOH溶液反应 | B. | KNO3加入水中 | ||
| C. | NH4NO3加入水中 | D. | CaO加入水中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
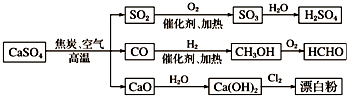
| A. | CO、SO2、SO3均是酸性氧化物 | |
| B. | 图示转化反应均为氧化还原反应 | |
| C. | 工业上利用Cl2和澄清石灰水反应来制取漂白粉 | |
| D. | 用CO合成CH3OH,原子利用率为100% |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
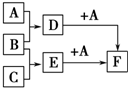 已知A、B、C是三种常见的单质,其中A为固体,B、C为气体;D的饱和溶液滴入沸水中继续煮沸,溶液呈红褐色;B和C反应的产物极易溶于水得无色溶液E.它们之间转化关系如图所示.
已知A、B、C是三种常见的单质,其中A为固体,B、C为气体;D的饱和溶液滴入沸水中继续煮沸,溶液呈红褐色;B和C反应的产物极易溶于水得无色溶液E.它们之间转化关系如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 放电时,正极发生的反应是 Pb+SO4+2e═PbSO4 | |
| B. | 放电时,该电池的负极材料是铅板 | |
| C. | 放电时,电池中硫酸的浓度不断变大 | |
| D. | 放电时,每当消耗 1 mol 铅时转移电子 4 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 改变条件 | 平衡移动方向 | 体系内混合气体的颜色变化 |
| (1)加入氢气 | 正反应方向 | 变浅 |
| (2)升高温度 | 逆反应方向 | 变深 |
| (3)加入碘 | 正反应方向 | 变深 |
| (4)使容器的容积压缩到原来的一半 | 不移动 | 变深 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验变量 实验序号 | 银氨溶液的量/mL | |||
| 1 | ||||
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
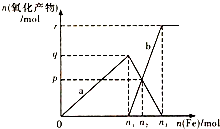 含有4molHNO3的稀硝酸分别与不同质量的铁粉反应,所得氧化产物a、b与铁粉物质的量关系如图所示.下列有关判断不正确的是( )
含有4molHNO3的稀硝酸分别与不同质量的铁粉反应,所得氧化产物a、b与铁粉物质的量关系如图所示.下列有关判断不正确的是( )| A. | a是Fe(NO3)3 | B. | n1=1 | C. | p=1.2 | D. | n3=1.5 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com