
【题目】电解装置如图所示,电解槽内装有KI及淀粉溶液,中间用阴离子交换膜隔开。在一定的电压下通电,发现左侧溶液变蓝色,一段时间后,蓝色逐渐变浅。
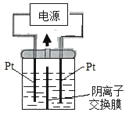
已知:3I2+6OH—=IO3—+5I—+3H2O
下列说法不正确的是
A. 右侧发生的电极方程式:2H2O+2e—=H2↑+2OH—
B. 电解结束时,右侧溶液中含有IO3—
C. 电解槽内发生反应的总化学方程式KI+3H2O=KIO3+3H2↑
D. 如果用阳离子交换膜代替阴离子交换膜,电解槽内发生的总化学方程式不变
【答案】D
【解析】
A.左侧溶液变蓝色,生成I2,左侧电极为阳极,右侧电极为阴极,阴极上氢离子得电子生成氢气,则右侧电极反应式为:2H++2e-═H2↑,故A正确;B.一段时间后,蓝色变浅,发生反应3I2+6OH-=IO3-+5I-+3H2O,中间为阴离子交换膜,右侧I-、OH-通过阴离子交换膜向左侧移动,保证两边溶液呈电中性,左侧的IO3-通过阴离子交换膜向右侧移动,故右侧溶液中含有IO3-,故B正确;C.左侧电极为阳极,电极反应为:2I--2e-=I2,同时发生反应3I2+6OH-=IO3-+5I-+3H2O,右侧电极为阴极,电极反应式为:2H2O+2e-=H2↑+2OH-,故总的电极反应式为:KI+3H2O![]() KIO3+3H2↑,故C正确;D.如果用阳离子交换膜代替阴离子交换膜,左侧电极为阳极,电极反应为:2I--2e-=I2,右侧电极为阴极,电极反应式为:2H2O+2e-=H2↑+2OH-,保证两边溶液呈电中性,左侧多余K+通过阳离子交换膜迁移至阴极,左侧生成I2,右侧溶液中有KOH生成,碘单质与KOH不能反应,总反应相当于:2KI+2H2O
KIO3+3H2↑,故C正确;D.如果用阳离子交换膜代替阴离子交换膜,左侧电极为阳极,电极反应为:2I--2e-=I2,右侧电极为阴极,电极反应式为:2H2O+2e-=H2↑+2OH-,保证两边溶液呈电中性,左侧多余K+通过阳离子交换膜迁移至阴极,左侧生成I2,右侧溶液中有KOH生成,碘单质与KOH不能反应,总反应相当于:2KI+2H2O![]() 2KOH+I2+H2↑,电解槽内发生的总化学方程式发生变化,故D错误;故答案为D。
2KOH+I2+H2↑,电解槽内发生的总化学方程式发生变化,故D错误;故答案为D。


 阳光课堂课时优化作业系列答案
阳光课堂课时优化作业系列答案科目:高中化学 来源: 题型:
【题目】下列表示化学过程的化学用语书写正确的是
A. BaSO4投入水中后建立的沉淀溶解平衡:BaSO4![]() Ba2++SO42-
Ba2++SO42-
B. AlCl3溶液与NaAlO2溶液混合:A13++A1O2-+3H2O![]() 2Al(OH)3↓
2Al(OH)3↓
C. HCO3-的电离:HCO3-+H2O![]() CO32-+H3O+
CO32-+H3O+
D. Na2SO3的水解:SO32-+2H2O![]() H2SO3+2OH-
H2SO3+2OH-
【答案】C
【解析】选项A的平衡应该标注各物质的状态,即为:BaSO4(s)![]() Ba2+(aq)+SO42-(aq),选项A错误。选项B的电荷不守恒,应该为A13++3A1O2-+6H2O
Ba2+(aq)+SO42-(aq),选项A错误。选项B的电荷不守恒,应该为A13++3A1O2-+6H2O![]() 4Al(OH)3↓,选项B错误。将选项C的方程式两边各去掉一个水分子,即得到:HCO3-
4Al(OH)3↓,选项B错误。将选项C的方程式两边各去掉一个水分子,即得到:HCO3-![]() CO32-+H+,表示的是碳酸氢根的电离,选项C正确。亚硫酸根离子的水解应该分步进行,选项D错误。
CO32-+H+,表示的是碳酸氢根的电离,选项C正确。亚硫酸根离子的水解应该分步进行,选项D错误。
【题型】单选题
【结束】
17
【题目】下列生活中的化学现象解释不正确的是
A. 生石灰可作食品速热剂是利用原电池原理
B. 泡沫灭火器是运用双水解原理产生CO2
C. 铝盐可作净水剂是利用铝离子水解产生胶体
D. 将煤气中毒的人移到通风处,是运用平衡理论
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高温下,某反应达到平衡,平衡常数![]() ,保持其他条件不变,若温度升高,c(H2)减小。对该反应的分析正确的是
,保持其他条件不变,若温度升高,c(H2)减小。对该反应的分析正确的是
A.反应的化学方程式为:CO+H2O![]() CO2+H2
CO2+H2
B.升高温度,v(正)、v(逆)都增大,且v(逆)增大更多
C.缩小容器体积,v(正)、v(逆)都增大,且v(正)增大更多
D.升高温度或缩小容器体积,混合气体的平均相对分子量都不会发生改变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,表中的每个字母表示一种短周期元素,回答下列问题:
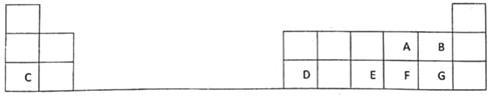
(1)画出A的原子结构示意图________。
(2)A、B、E、F、G五种元素所形成的气态氢化物最稳定的是________(填化学式)。
(3)D在元素周期表中的位置是第3周期________族。
(4)E、F元素的最高价氧化物对应水化物的酸性较强的是: ________(用化学式表示)。
(5)写出C和G形成化合物的电子式________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,氮气与氢气合成氨气的能量变化的曲线如图,下列叙述正确的是( )
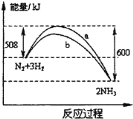
A.a历程使用了催化剂,b历程没有使用催化剂
B.使用催化剂可提高氮气的转化率
C.相同状况下,lmol氮气和3mol氢气总键能高于2mol氨气的总键能
D.该反应的热化学方程式为N2(g)+3H2(g)![]() 2NH3(g) △H=-92kJ·mol-1
2NH3(g) △H=-92kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对如图两种化合物的结构或性质描述正确的是
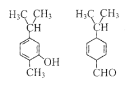
A.不是同分异构体
B.分子中共平面的碳原子数一定相同
C.均能与溴水反应且反应类型不同
D.可用NaOH溶液、银氨溶液、酸性KMnO4溶液区分
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液可能含有Na+、NH4+、Mg2+、Al3+、SO42-、NO3-、Cl-中的几种,为确定其成分,完成了如下实验(已知:3NO3-+8Al+5OH-+2H2O ![]() 3NH3↑+ 8AlO2- )
3NH3↑+ 8AlO2- )
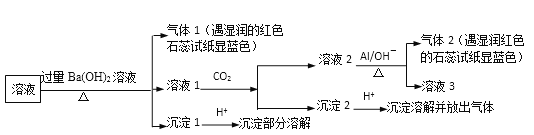
根据实验现象,所得结论错误的是
A.沉淀1加酸部分溶解,则含Mg2+和SO42-B.可能含Na+、Cl-
C.沉淀2加酸溶解,则含Al3+D.气体1遇水显碱性,则含NH4+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏伽德罗常数的值,下列说法正确的是( )
A.60gSiO2晶体中含有Si—O键数目为2NA
B.常温常压下,32g16O2中所含的中子数为16NA
C.电解饱和食盐水,阳极上生成22.4L气体时转移的电子数为2NA
D.密闭容器中2molNO与lmolO2充分反应,产物的分子数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硝酸是一种重要的化工原料,完成下列填空:
I、工业上生产硝酸的主要过程如下:
(1)以N2和H2为原料合成氨气。反应为:N2(g)+3H2(g) ![]() 2NH3(g)+Q。
2NH3(g)+Q。
(2)下列措施可以提高H2的转化率的是(填选项序号)_____________。
a.选择适当的催化剂 b.增大压强 c.及时分离生成的NH3 d.升高温度
(3)一定温度下,在密闭容器中充入1molN2和3molH2发生反应。若容器容积恒定,达到平衡状态时,气体的总物质的量是原来的15/16,则N2的转化率α1=_____;若容器压强恒定,达到平衡状态时,N2的转化率为α2,则α2___α1 (填“>”、“<”或“=”)。
II、以氨气、空气为主要原料制硝酸。
(4)氨气催化氧化的催化剂是___________;氨气也可以在纯氧中燃烧生成无毒、无污染的产物,其燃烧方程式为_____________。
(5)在容积恒定的密闭容器中进行反应2NO(g)+O2(g)![]() 2NO2(g)-Q。该反应的反应速率(v)随时间(t)变化的关系如图所示。若t2、t4时刻只改变一个条件,下列说法正确的是(填选项序号)______。
2NO2(g)-Q。该反应的反应速率(v)随时间(t)变化的关系如图所示。若t2、t4时刻只改变一个条件,下列说法正确的是(填选项序号)______。
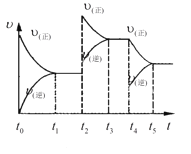
a.在t1-t2时,可依据容器内气体的压强保持不变判断反应已达到平衡状态
b.在t2时,采取的措施可以是升高温度
c.在t3-t4时,可依据容器内气体的密度保持不变判断反应已达到平衡状态
d.在t5时,容器内NO2的体积分数是整个过程中的最大值
III、硝酸厂常用如下2种方法处理尾气。
(6)催化还原法:催化剂存在时用H2将NO2还原为N2。
已知:2H2(g)+ O2(g)→2H2O(g) + 483.6 KJ
N2(g)+ 2O2(g)→2NO2 (g) + 67.7KJ
则H2还原NO2生成水蒸气反应的热化学方程式是_________。
(7)碱液吸收法:用Na2CO3溶液吸收NO2生成CO2。若9.2gNO2和Na2CO3溶液完全反应时转移电子0.1mol,则反应的离子方程式是______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com