
| 序号 | 实验操作 | 实验现象 |
| 1 | 取0.3g 纯净Na2SO3固体,向其中加入10mL 2mol•L-1 盐酸,再滴入4滴BaCl2溶液 | 产生无色气泡;滴入BaCl2溶液后,开始无现象,4min后,溶液变浑浊 |
| 2 | 取0.3g 纯净Na2SO3固体,向其中加入10mL 2mol•L-1 HNO3,再滴入4滴BaCl2溶液 | 产生无色气泡;滴入BaCl2溶液后,开始无现象,2h后,溶液变浑浊 |
| 3 | 取0.3g 纯净Na2SO3固体,向其中加入10mL 浓HNO3,再滴入4滴BaCl2溶液 | 产生红棕色气体;滴入BaCl2溶液后,溶液立即产生大量白色沉淀 |
| 序号 | 实验操作 | 实验现象 |
| 4 | 取0.3g纯净Na2SO3和1.17gNaCl固体混合物,向其中加入10mL 2mol•L-1 HNO3,再滴入4滴BaCl2溶液 | 产生无色气泡;滴入BaCl2溶液后,开始无现象,20min后,溶液变浑浊 |
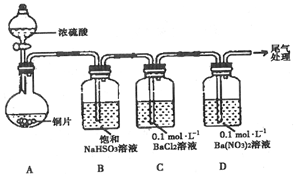
分析 (1)①铜和浓硫酸加热发生反应生成硫酸铜、二氧化硫和水;
②出现白色沉淀的过程中,D溶液中NO3-浓度几乎不变说明酸性溶液中二氧化硫会被氧气氧化生成硫酸,结合钡离子生成硫酸钡沉淀;
(2)①取0.3g 纯净Na2SO3固体,向其中加入10mL 2mol•L-1 盐酸,再滴入4滴BaCl2溶液,产生无色气泡为二氧化硫气体,滴入BaCl2溶液后,开始无现象,4min后,溶液变浑浊,说明二氧化硫被空气中氧气氧化生成硫酸,结合钡离子生成硫酸钡白色沉淀;
②由实验1、2、3对比可知氧气、浓硝酸都可以氧化二氧化硫;
③探究Cl-和NO3-对其的影响,实验2和4对比,乙获得推论:Cl-的存在可以加快溶液中+4价硫元素的氧化,实验4中需要提供和实验1中相同的氯离子实验探究,即需要0.01L×2mol/L=0.02mol,据此和出现沉淀的时间分析;
ii.实验1和4对比,不同的是盐酸和硝酸,氯离子相同,出现沉淀的时间是盐酸溶液中快,乙获得推论是硝酸根离子减慢+4价硫的化合物的氧化;
④亚硫酸氢钠溶液可以吸收三氧化硫生成二氧化硫气体;
解答 解:(1)①铜和浓硫酸加热发生反应生成硫酸铜、二氧化硫和水,反应的化学方程式为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O,
故答案为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O;
②为探究SO2在D中所发生的反应,甲进一步实验发现,出现白色沉淀的过程中,D溶液中NO3-浓度几乎不变.甲据此得出结论:D中出现白色沉淀的主要原因是酸性溶液中二氧化硫会被氧气氧化生成硫酸,结合钡离子,也能生成硫酸钡沉淀,酸性条件下,含+4价硫元素物质(SO2或H2SO3)被O2氧化生成SO42-
故答案为:A;
(2)①取0.3g 纯净Na2SO3固体,向其中加入10mL 2mol•L-1 盐酸,再滴入4滴BaCl2溶液,产生无色气泡为二氧化硫气体,滴入BaCl2溶液后,开始无现象,4min后,溶液变浑浊,说明二氧化硫被空气中氧气氧化生成硫酸,结合钡离子生成硫酸钡白色沉淀,反应的离子方程式为:2H++SO32-═SO2+H2O,2SO2+O2+2Ba2++2H2O═2BaSO4↓+4H+或2H2SO3+O2+2Ba2+═2BaSO4↓+4H+,
故答案为:2H++SO32-═SO2+H2O,2SO2+O2+2Ba2++2H2O═2BaSO4↓+4H+或2H2SO3+O2+2Ba2+═2BaSO4↓+4H+;
②由实验1说明空气中氧气也可以氧化+4价硫元素的化合物,实验2说明硝酸溶液中硝酸根离子对氧化反应起到减慢作用,出现沉淀时间长,实验3是浓硝酸能氧化+4价硫元素化合物生成硫酸根离子,出现沉淀快,对比可知氧气、浓硝酸都可以氧化二氧化硫,
故答案为:含+4价硫元素物质可被O2和浓HNO3氧化;
③探究Cl-和NO3-对其的影响,实验2和4对比,乙获得推论:Cl-的存在可以加快溶液中+4价硫元素的氧化,实验4中需要提供和实验1中相同的氯离子实验探究,即需要0.01L×2mol/L=0.02mol,氯化钠的质量=0.02mol×58.5g/mol=1.17g,对比实验1判断出现沉淀的时间分析,取0.3g 纯净Na2SO3和1.17gNaCl固体,向其中加入10mL 2mol•L-1 HNO3,再滴入4滴BaCl2溶液,观察出现沉淀的时间,
故答案为:0.3g纯净Na2SO3和1.17gNaCl;
ii.实验1和4对比,不同的是盐酸和硝酸,氯离子相同,出现沉淀的时间是盐酸溶液中快,乙获得推论是硝酸根离子减慢+4价硫的化合物的氧化,实验1和4对比,乙获得推论是:NO3-的存在可以减慢溶液中+4价硫元素的氧化,
故答案为:NO3-的存在可以减慢溶液中+4价硫元素的氧化;
④通过以上实验,可以推测B装置最有可能的作用是:吸收+6价硫的化合物,
故答案为:吸收+6价硫的化合物;
点评 本题考查了物质性质的实验探究、实验方案的分析和设计、主要是反应现象的不同原因分析判断,实验对比分析是探究实验的常用方法,注意信息提取和现象的理解应用,题目难度较大.


科目:高中化学 来源: 题型:选择题
| A. | 1:2 | B. | 4:3 | C. | 2:1 | D. | 3:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
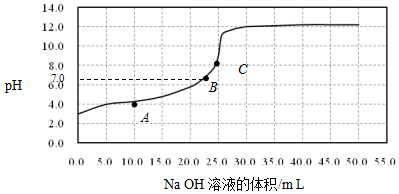
| A. | 在A点:c(HX)>c(Na+)>c(X-) | |
| B. | 在B点,溶液中c(H+)=c(OH-) | |
| C. | C点溶液中存在的主要平衡是X-+H2O?HX+OH- | |
| D. | 0.05mol/L NaX溶液的pH≈9 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 20°C时,28g N2所含的原子数为2NA个 | |
| B. | 标况下,0.5NA个水分子所占体积约为11.2L | |
| C. | CH4的摩尔质量在数值上等于NA个甲烷分子的质量之和 | |
| D. | 1gCO与1gCO2所含碳原子数之比是1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
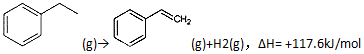
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 (1)常温下,0.5mol甲醇在氧气中充全燃烧生成CO2和液态水,放出热量363.3kJ.写 出甲醇燃烧的热化学方程式CH3OH(l)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O(l)△H=-726.6kJ•mol-1.
(1)常温下,0.5mol甲醇在氧气中充全燃烧生成CO2和液态水,放出热量363.3kJ.写 出甲醇燃烧的热化学方程式CH3OH(l)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O(l)△H=-726.6kJ•mol-1.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | x等于6 | |
| B. | 性质稳定,不易脱色 | |
| C. | 易溶解于强酸和强碱 | |
| D. | 可用氧化物形式表示为BaO•CuO•2SiO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaNO2 | B. | AgNO3 | C. | BaCO3 | D. | BaSO4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com