
【题目】已知下列热化学方程式:Zn(s) +![]() O2(g) =ZnO(s) ΔH1=-351.1kJ/mol
O2(g) =ZnO(s) ΔH1=-351.1kJ/mol
Hg(l) +![]() O2(g) = HgO(s) ΔH2=-90.7kJ/mol
O2(g) = HgO(s) ΔH2=-90.7kJ/mol
由此可知Zn(s) + HgO(s) = ZnO(s) + Hg(l)的ΔH3,其中ΔH3的值是
A.-260.4 kJ/molB.-254.6 kJ/molC.-438.9 kJ/molD.-441.8 kJ/mol
 英才点津系列答案
英才点津系列答案 红果子三级测试卷系列答案
红果子三级测试卷系列答案科目:高中化学 来源: 题型:
【题目】GaN是制造5G芯片的材料,氮化镓铝和氮化铝LED可发出紫外光。回答下列问题:
(1)基态As原子核外电子排布式为[Ar]____________;下列状态的铝元素中,电离最外层的一个电子所需能量最小的是______________(填标号)。
A.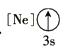 B.
B.![]() C.
C.![]() D.
D.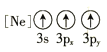
(2)8—羟基喹啉合铝(分子式C27H18AlN3O3)用于发光材料及电子传输材料,可由LiAlH4与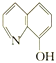 8—羟基喹啉)合成。LiAlH4中阴离子的空间构型为______________; 8—羟基喹啉合铝中所含元素电负性最大的是______________(填元素符号,下同),第一电离能最大的是__________(填元素符号),N原子的杂化方式为_____________。
8—羟基喹啉)合成。LiAlH4中阴离子的空间构型为______________; 8—羟基喹啉合铝中所含元素电负性最大的是______________(填元素符号,下同),第一电离能最大的是__________(填元素符号),N原子的杂化方式为_____________。
(3)已知下列化合物的熔点:
化合物 | AlF3 | GaF3 | AlCl3 |
熔点/℃ | 1040 | 1000 | 194 |
①表格中卤化物的熔点产生差异的原因是_______________________________________________。
②熔融AlCl3时可生成具有挥发性的二聚体Al2Cl6分子,分子中每个原子最外层均达到8电子,二聚体Al2Cl6的结构式为______________________________;其中Al的配位数为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中,正确的是
A.78g Na2O2固体含有离子的数目为4NA
B.由水电离出的c(H+)=1012mol·L1溶液中Na+、NH4+、SO42、NO3 一定能大量共存
C.硫酸酸化的KI淀粉溶液久置后变蓝的反应为:4I+O2+4H+=2I2+2H2O
D.将充有NO2的玻璃球浸到热水中气体颜色加深说明2NO2(g)![]() N2O4(g) △H >0
N2O4(g) △H >0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】盖斯定律在生产和科学研究中有很重要的意义。有些反应的反应热虽然无法直接测得,但可通过间接的方法测定。现根据下列3个热化学反应方程式:
Fe2O3(s)+3CO(g)="=" 2Fe(s)+3CO2(g) △H= ―24.8kJ/mol
3Fe2O3(s)+ CO(g)==2Fe3O4(s)+ CO2(g) △H= ―47.2kJ/mol
Fe3O4(s)+CO(g)==3FeO(s)+CO2(g) △H= +640.5kJ/mol
写出CO气体还原FeO固体得到Fe固体和CO2气体的热化学反应方程式:
_________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W为原子序数依次增大的四种短周期元素,其中Z为金属元素,X、W为同一主族元素。X、Z、W形成的最高价氧化物分别为甲、乙、丙。x、y2、z、w分别为X、Y、Z、W的单质,丁是化合物。其转化关系如图所示,下列判断错误的是( )

A. 反应①、②、③都属于氧化还原反应 B. X、Y、Z、W四种元素中,Y的原子半径最小
C. Na着火时,可用甲扑灭 D. 一定条件下,x与甲反应生成丁
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图,A池用石墨电极电解NaOH溶液,B池精炼粗铜,一段时间后停止通电,A池中D极产生具有氧化性的气体在标准状况下为2.24L。下列说法正确的是( )
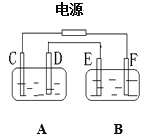
A.A池为电解池,B池为原电池
B.D、E两极都发生氧化反应
C.E极应为粗铜板材料
D.B池中E极质量增加12.8g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求对如图中两极进行必要的联接并填空:
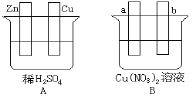
(1)在A图中,使铜片上冒H2气泡。请加以必要联接___,则联接后的装置叫___。电极反应式:锌板:___;铜板:___。
(2)在B图中(a、b均为惰性电极),使a极析出铜,则b析出:___。加以必要的联接后,该装置叫___。电极反应式,a极:___,b极:___。经过一段时间后,停止反应并搅均溶液,溶液的pH值___(升高、降低、不变),加入一定量的___后,溶液能恢复至与电解前完全一致。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下Fe2O3可被甲烷还原为“纳米级”的金属铁,其反应:Fe2O3(s)+3CH4(g)2Fe(s)+3CO(g)+6H2(g) ΔH,在容积固定且均为1L的Ⅰ、Ⅱ、Ⅲ三个相同密闭容器中加入足量“纳米级”的金属铁,然后分别充入1molCO和2molH2,三个容器的反应温度分别为T1、T2、T3(依次升高)且恒定不变,测得反应均进行到t min时CO的体积分数如图所示。下列说法正确的是( )
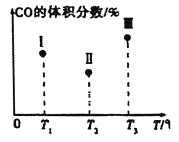
A.该反应的ΔH>0
B.容器Ⅲ中CO的体积分数可能为35%
C.容器中固体的质量不再改变,不能说明反应已达平衡状态
D.反应进行到tmin时,三个容器中一定达到平衡状态的是Ⅱ和Ⅲ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式及有关应用的叙述中,正确的是
A.甲烷的燃烧热为890.3kJmol-1,则甲烷燃烧的热化学方程式可表示为: CH4(g)+![]() O2(g) ═ CO(g) + 2H2O(l) △H = -890.3kJmol-1
O2(g) ═ CO(g) + 2H2O(l) △H = -890.3kJmol-1
B.已知稀溶液中,H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3kJ·mol-1,则稀醋酸与稀氢氧化钠溶液反应生成1mol水时放出57.3kJ的热量
C.500℃下,将0.5mol I2(g)和0.5molH2(g)置于密闭的容器中充分反应生成HI(g),放热10kJ,其热化学方程式为:I2(g) + H2(g)![]() 2HI(g) △H = -20kJmol-1
2HI(g) △H = -20kJmol-1
D.已知25℃、101KPa条件下:4Al(s) + 3O2(g) ═ 2A12O3(s) △H = -2834.9kJmol-1, 4Al(s) + 2O3(g) ═ 2A12O3(s) △H = -3119.1kJmol-1,则O2比O3稳定
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com