
 ,G
,G ;
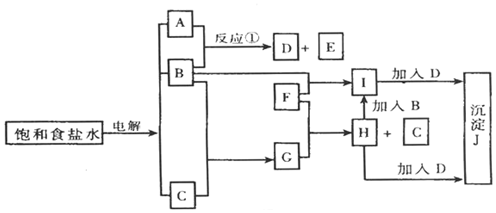
;分析 饱和食盐水电解的产物是NaOH、Cl2、H2.三者之间存在的反应是H2+Cl2═2HCl、2NaOH+Cl2═NaCl+NaClO+H2O.由图示:B能与另两种生成物反应,所以B为Cl2;又B与A反应产物有两种所以C一定为H2,A为NaOH,G为HCl;再由F+Cl2→I,F+HCl→H+H2,H+Cl2→I,可推知F为变价金属,可确定为Fe;H和I分别为FeCl2和FeCl3;最后注意理解D与H、I的反应.由题知D、E为NaCl、NaClO,通过上述分析可认定D应为NaClO,有关反应为:I→J?Fe3++3ClO-+3H2O═Fe(OH)3↓+3HClO,发生了双水解反应.而H→J可理解为生成Fe(OH)2,但HClO有强氧化性进而将Fe(OH)2氧化为Fe(OH)3.以此解答该题.
解答 解:(1)由以上分析可知D为NaClO,F为Fe,H为FeCl2,J为Fe(OH)3,故答案为:NaClO;Fe; FeCl2;Fe(OH)3;
(2)A为NaOH,电子式为 ,G为HCl,电子式为
,G为HCl,电子式为 ,故答案为:
,故答案为: ;
; ;
;
(3)反应①为氯气和氢氧化钠的反应,离子方程式为Cl2+2OH-=Cl-+ClO-+H2O,I为FeCl3,为强酸弱碱盐,水解呈酸性,离子方程式为Fe3++3H2O?Fe(OH)3+3H+,氯气和氯化亚铁反应生成氯化铁,反应的离子方程式为Cl2+2Fe2+=2Cl-+2Fe3+,H+D+H2O的反应为次氯酸盐和亚铁离子的反应,离子方程式为5ClO-+2Fe2++5H2O=2Fe(OH)3+Cl-+4HClO,
故答案为:Cl2+2OH-=Cl-+ClO-+H2O;Fe3++3H2O?Fe(OH)3+3H+;Cl2+2Fe2+=2Cl-+2Fe3+;5ClO-+2Fe2++5H2O=2Fe(OH)3+Cl-+4HClO;
(4)碱性氢氧燃料电池中负极为氢气的氧化反应,电极方程式为H2+2OH--2e-═2H2O或2H2+4OH--4e-═4H2O,
故答案为:H2+2OH--2e-═2H2O或2H2+4OH--4e-═4H2O.
点评 本题考查无机物的推断,为高考常见题型,侧重考查学生的分析能力,题目难度中等,注意饱和食盐水电解的产物是NaOH、Cl2、H2,根据三者之间存在的反应结合物质的性质解答.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
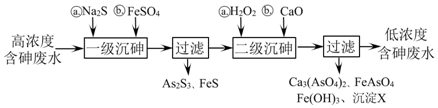
 ;②步骤2的离子方程式为12Ag++2H3As+3H2O═12Ag↓+As2O3+12H+;
;②步骤2的离子方程式为12Ag++2H3As+3H2O═12Ag↓+As2O3+12H+;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 230Th和232Th的化学性质相同 | B. | Th元素的相对原子质量是231 | ||
| C. | 232Th转化成233U是化学变化 | D. | Th元素的质量数是232 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 全部由非金属元素组成的化合物中可含离子键 | |
| B. | H2O中所有原子都满足八电子稳定状态 | |
| C. | 两种元素构成的化合物可以含有非极性共价键 | |
| D. | CH4中所有的电子都参与形成共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 制备CH3CHCl2:乙烷在光照条件下和氯气反应或乙烯和氯水反应 | |
| B. | 沸点和在水中的溶解度:乙醇大于乙烷 | |
| C. | 鉴别溴苯和CCl4:硝酸银溶液 | |
| D. | 除去乙酸乙酯中混有的乙酸和乙醇:NaOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 通入澄清的石灰水 | |
| B. | 通入品红溶液 | |
| C. | 依次通过澄清石灰水和酸性KMnO4溶液 | |
| D. | 依次通过小苏打溶液和澄清石灰水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用平行光照射氯化钠溶液和氢氧化铁胶体,产生的现象相同 | |
| B. | 铝具有较强的抗腐蚀性质,是因为铝与氧气常温下不反应 | |
| C. | 实验室用MnO2和稀盐酸反应制取氯气 | |
| D. | 工业上用电解熔融氧化铝制取金属铝 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 玻璃容器可长期盛放各种酸 | B. | 金刚砂主要成分为碳化硅,硬度大 | ||
| C. | 浓硫酸可刻蚀石英制艺术品 | D. | 84消毒液的有效成分是NaClO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使用含有氯化钙的融雪剂会加速桥梁的腐蚀 | |
| B. | 雾霾是一种分散系,N95活性炭口罩可用于防霾,其原理是吸附作用 | |
| C. | 大力推广使用煤的液化、气化技术,能减少二氧化碳的排放 | |
| D. | 晶体硅制得的光电池,能直接将光能转化为电能 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com