
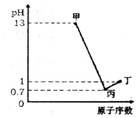
 X、Y、Z、W为四种短周期元素,它们的最高价氧化物对应水化物分别为甲、乙、丙、丁,常温下甲、丙、丁均可与乙反应生成盐和水,X、Z、W的原子序数及0.1mol/L甲、丙、丁溶液的pH如图所示(已知lg2=0.3).下列说法正确的是( )
X、Y、Z、W为四种短周期元素,它们的最高价氧化物对应水化物分别为甲、乙、丙、丁,常温下甲、丙、丁均可与乙反应生成盐和水,X、Z、W的原子序数及0.1mol/L甲、丙、丁溶液的pH如图所示(已知lg2=0.3).下列说法正确的是( )| A. | 简单阴离子的还原性:Z<W | |
| B. | X、Y分别与W形成的化合物皆为离子化合物 | |
| C. | 乙固体中加入甲的溶液或浓氨水,固体都能溶解 | |
| D. | Y、Z的简单离子都会影响水的电离平衡 |
分析 Y、Z、W为四种短周期元素,它们的最高价氧化物对应水化物分别为甲、乙、丙、丁,0.1mol/L的甲溶液的pH=13,则为一元强碱,只能为NaOH,则Na元素;0.1 mol/L的丁溶液pH=1,则丁为一元含氧酸,且W的原子序数大于Na元素,则W为Cl元素、W为HClO4;0.1 mol/L的丙溶液pH=0.7,则氢离子浓度为10-0.7mol/L=0.2mol/L,故丙为二元强酸,且Z的原子序数大于Na元素,则Z为S元素、Z为H2SO4;常温下甲、丙、丁均可与乙反应生成盐和水,则乙为两性氢氧化物,则乙为Al(OH)3、Y为Al元素,据此进行解答.
解答 解:Y、Z、W为四种短周期元素,它们的最高价氧化物对应水化物分别为甲、乙、丙、丁,0.1mol/L的甲溶液的pH=13,则为一元强碱,只能为NaOH,则X为Na元素;0.1 mol/L的丁溶液pH=1,则丁为一元含氧酸,且W的原子序数大于Na元素,则W为Cl元素、W为HClO4;0.1 mol/L的丙溶液pH=0.7,则氢离子浓度为10-0.7mol/L=0.2mol/L,故丙为二元强酸,且Z的原子序数大于Na元素,则Z为S元素、Z为H2SO4;常温下甲、丙、丁均可与乙反应生成盐和水,则乙为两性氢氧化物,则乙为Al(OH)3、Y为Al元素,
A.Z、W分别为S、Cl元素,非金属性越强,对应离子的还原性越弱,非金属性Cl>S,则简单阴离子的还原性:Z(S2-)>W(Cl-),故A错误;
B.X、Y、W分别为Na、Al、Cl元素,X、Y分别与W形成的化合物为NaCl、氯化铝,氯化钠为离子化合物,氯化铝为共价化合物,故B错误;
C.乙为Al(OH)3,氢氧化铝溶于氢氧化钠,但不溶于氨水,故C错误;
D.Y、Z的简单离子分别为铝离子、硫离子,铝离子和硫离子都发生水解促进了水的电离,故D正确;
故选D.
点评 本题考查位置、结构与性质关系的应用,题目难度中等,推断元素为解答关键,注意掌握原子结构与元素周期律、元素周期表的关系,试题培养了学生的逻辑推理能力.


 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:高中化学 来源: 题型:填空题
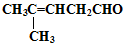 检验分子中醛基的所用的试剂是银氨溶液(或新制备氢氧化铜浊液),化学方程式为
检验分子中醛基的所用的试剂是银氨溶液(或新制备氢氧化铜浊液),化学方程式为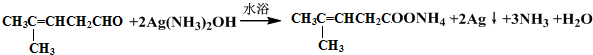 或
或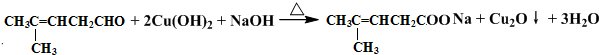 ;
;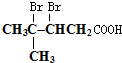 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
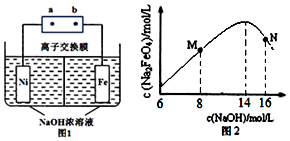
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 盛装未知液的锥形瓶用蒸馏水洗过,未用未知液润洗 | |
| B. | 滴定终点读数时,俯视滴定管的刻度,其他操作正确 | |
| C. | 滴定到终点读数时,发现滴定管尖嘴内有气泡 | |
| D. | 配制标准溶液的NaOH中混有KOH杂质 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
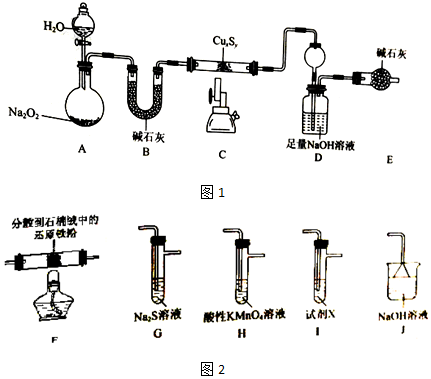
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
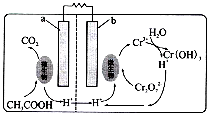
| A. | b极为负极 | |
| B. | a极反应式:CH3COOH+2H2O-8e-=2CO2+8H+ | |
| C. | 每处理1mol Cr2O72-生成CO2(标准状况下)3.36 L | |
| D. | 每生成lmol Cr(OH)3,右池n(H+)减少2 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.0mol•L-1NaClO溶液中:Fe2+、K+、I-、Cl- | |
| B. | 加入铝片能放出H2的溶液中:K+、Ba2+、Cl-、NH4+ | |
| C. | 由水电离出的c(OH-)=1×10-12mol•L-1溶液中:NH4+、HCO3-、Na+、Cl- | |
| D. | $\frac{c({H}^{+})}{c(O{H}^{-})}$=1×10-14的溶液中:K+、Na+、I-、SiO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 镁铝合金粉末着火后可用干冰灭火器灭火 | |
| B. | 自来水中的亚硝胺超标会危害人体健康 | |
| C. | 装潢涂料用苯作溶剂比用水作溶剂好 | |
| D. | 提倡使用一次性筷子、纸杯等,更有利于保护环境 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验目的 | 实验操作 |
| A | 制备乙炔时,减缓乙炔的生成速率 | 用饱和食盐水替代水跟电石反应 |
| B | 证明NH4Cl溶液能促进Mg(OH)2固体的溶解 | 向两份等量的Mg(OH)2固体中分别加入等体积的蒸馏水和NH4Cl溶液 |
| C | 验证乙醇发生消去反应生成乙烯 | 将生成的气体直接通入含Br2的CCl4溶液中 |
| D | 证明Al2O3的熔点比Al高 | 把砂纸打磨过的铝箔在酒精灯上加热至熔化 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com