
【题目】下列关于能层与能级的说法中正确的是( )
A. 同一原子中,符号相同的能级,其上电子能量不一定相同
B. 任一能层的能级总是从s能级开始,而且能级数不一定等于该能层序数
C. 同是s能级,在不同的能层中所能容纳的最多电子数是不相同的
D. 多电子原子中,每个能层上电子的能量一定不同
科目:高中化学 来源: 题型:
【题目】以对甲苯酚A为起始原料,通过一系列反应合成有机物G和F。

已知:

 (羟醛缩合反应)
(羟醛缩合反应)
(1)D中含氧的官能团______________ ⑥反应类型_______________。
(2)若C和甲乙酮(![]() )在上述条件下,发生类似Ⅱ的反应产生互为同分异构体的两种有机物,写出它们的结构简式______________________________、_______________________________。
)在上述条件下,发生类似Ⅱ的反应产生互为同分异构体的两种有机物,写出它们的结构简式______________________________、_______________________________。
(3)写出反应②的化学方程式____________________________________________________________。
(4)在反应⑤之前增加步骤④的目的是___________________________。
(5)符合下列条件的F同分异构体有__________种
①发生银镜反应 ②与FeCl3溶液发生显色反应 ③苯环上一氯代物有两种
(6)参照上述合成路线和相关信息,设计以乙醛为原料(无机试剂任选)制备高级吸水性树脂 的合成路线_____________。
的合成路线_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用铁片与稀硫酸反应制取氢气时,下列措施不能使反应速率加快的是( )
A.加热
B.不用稀硫酸改用98%的浓硫酸
C.滴加少量硫酸铜溶液
D.不用铁片,改用铁粉
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知H2CO3和H2SO3的电离常数如下表:
酸 | Ka1 | Ka2 |
H2CO3 | 4.27×10-7 | 5.61×10-11 |
H2SO3 | 1.54×10-2 | 1.02×10-7 |
向10mL0.1mol/LNa2CO3溶液中滴加0.1mol/LH2SO3溶液,测得溶液pH随加入H2SO3溶液体积的变化如图所示。
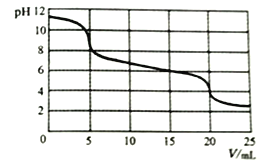
下列说法不正确的是
A. 加入H2SO3溶液前,Na2CO3溶液中:c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3)
B. 0<V<5时,溶液中反应为:H2SO3+CO32-==HCO3-+HSO3-
C. 15<V<20时,溶液中反应为:H2SO3+HCO3-==HSO3-+CO2↑+H2O
D. V=15时,所得溶液中:(HCO3-)<c(HSO3-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以红土镍矿(主要成分为NiS、FeS和SiO2等)为原料制备兰尼镍的工艺流程如下所示。

(1)形成Ni(CO)4时碳元素的化合价没有变化,则Ni(CO)4中的Ni的化合价为___________。
(2)Ni2O3有强氧化性,加压酸浸时有气体产生且镍被还原为Ni2+,则产生的气体为______(填化学式)。
(3)滤渣D为单质镍、硫的混合物,请写出向浸出液B中通入H2S气体时所有反应的离子方程式:__________________________,_________________________。
(4)已知:3Fe2++2[Fe(CN)6]3-==Fe3[Fe(CN)6]2↓(蓝色沉淀);4Fe3++3[Fe(CN)6]4-==Fe4[Fe(CN)6]3↓(蓝色沉淀)。下列可以用于检验滤液C中金属阳离子的试剂有____________(填标号)
a.KSCN溶液 b.K3[Fe(CN)6] c.K4[Fe(CN)6] d.苯酚
(5)兰尼镍是一种带有多孔结构的细小晶粒组成的镍铝合金。碱浸镍铝合金后,残铝量对兰尼镍的催化活性有重大影响,根据下图分析,残铝量在_____范围内催化活性最高,属于优质产品。

(6)仿照下面示例,设计从浸出液E回收氧化铝的流程:浸出液E_________________。
(示例:![]() )
)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分离下列三组混合物依次采取的方法正确的是:①水和乙醇②植物油和氯化钠溶液③碳酸钙和氯化钙的溶液( )
A.蒸发、蒸馏、萃取
B.蒸馏、分液、过滤
C.分液、过滤、加热升华
D.蒸馏、萃取、分液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某元素的激发态原子的电子排布式为1s22s22p63s23p34s1,则该元素基态原子的电子排布式为____________;元素符号为________;其最高价氧化物对应的水化物的化学式是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知二氧化碳和氢气在一定条件下可以合成甲醇,其制备反应为:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),下列说法正确的是
CH3OH(g)+H2O(g),下列说法正确的是
A. 调控反应条件不能改变反应限度
B. 化学反应的限度决定了反应物在该条件下的最大转化率
C. 当CO2的消耗速率等于其生成速率时,该反应已停止
D. 投入1molCO2能得到1mol的CH3OH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“银-菲洛嗪法”是检测居室内甲醛(化学式CH2O)含量的常用方法之一。化学学习小组利用其原理设计如下装置测定新装修居室内空气中甲醛的含量。(夹持装置略去)

已知:甲醛能被银氨溶液、酸性KMnO4氧化生成CO2;10-5mol·L-1的紫色KMnO4溶液遇甲醛气体即褪色;毛细管内径不超过1mm。
请回答下列问题:
(1)银氨溶液的制备。打开K3,打开分液漏斗活塞,将饱和食盐水慢慢滴入圆底烧瓶中。饱和食盐水的作用是_________________________,当观察到三颈烧瓶中__________时,关闭K3和分液漏斗活塞。
(2)室内空气中甲醛含量的测定
①用热水浴加热三颈烧瓶,打开K1,将滑动隔板慢慢由最右端抽到最左端,吸入1L室内空气,关闭K1。打开K2,缓慢推动滑动隔板,将气体全部推出,关闭K2。装置中毛细管的作用是______________。
再重复上述操作四次。
②向充分反应后的溶液中加入稀硫酸调节溶液pH=1,再加入足量Fe2(SO4)3溶液,写出加入Fe2(SO4)3溶液后发生反应的离子方程式______________________________。立即加入菲洛嗪,Fe2+与菲洛嗪形成有色物质,在562nm处测定吸光度,测得生成Fe2+ 1.12mg。空气中甲醛的含量为___________mg·L-1。
(3)关闭K3,将三颈烧瓶中的溶液换为40.00mL 10-4mol· L-1的KMnO4溶液,量取KMnO4溶液使用的仪器是_____________。再加入2mL 6mol·L-1的硫酸酸化后重新测定空气中甲醛的含量。当三颈瓶中溶液恰好褪色时,向容器A中共抽气________次。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com