
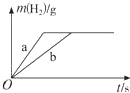
| A. | 曲线a为K,b为Na | |
| B. | 稀盐酸一定不足量 | |
| C. | 投入Na、K一定等质量 | |
| D. | 投入Na的物质的量小于K的物质的量 |
分析 A、根据金属的活泼性判断反应速率大小,金属钾的活泼性大于钠;
B、钠、钾不仅和盐酸反应还和水反应;
C、由图象分析知,两种金属与盐酸反应生成氢气的量相等,根据氢气的量计算金属的量;
D、根据氢气的量计算金属的质量进行比较.
解答 解:A、因为钾的金属性大于钠,所以钾与酸反应速率大于钠与酸反应速率,即生成相同物质的量的氢气,钾需要的时间短,钠需要的时间长,所以曲线a为钾,b为钠,故A正确;
B、因为钠、钾不仅和盐酸反应还和水反应,所以钠、钾生成相同物质的量的氢气与稀盐酸是否足量无关,故B错误;
C、由图象知,金属和酸反应生成氢气的量相等,
2Na+2HCl=2NaCl+H2↑,
46g 1mol
2K+2HCl=2KCl+H2↑,
78g 1mol
通过方程式知,生成相同物质的量的氢气需要金属的质量不同,故C错误;
D、通过C选项知,生成相同物质的量的氢气需要金属的质量不同,需要钾的质量大于钠的,但物质的量相等,故D错误;
故选A.
点评 本题考查了碱金属元素的性质,难度不大,解答本题时注意:钠、钾不仅和盐酸反应还和水反应.


 文敬图书课时先锋系列答案
文敬图书课时先锋系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如图是研究铜与浓硫酸的反应装置:
如图是研究铜与浓硫酸的反应装置:| 资料1 |
| ||||||||||||
| 资料2 | X射线晶体分析表明,铜与浓硫酸反应生成的黑色物质为Cu2S、CuS、Cu7S4中的一种或几种. |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ⑤ | ⑥ | ||||||
| 3 | ① | ③ | ⑦ | ④ | ||||
| 4 | ② |
 (填电子式),该氢化物在常温下与②发生反应的化学方程式为2K+2H2O=2KOH+H2↑.
(填电子式),该氢化物在常温下与②发生反应的化学方程式为2K+2H2O=2KOH+H2↑.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
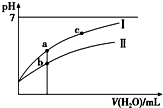 已知:25℃时某些弱酸的电离平衡常数(如表).下面图象表示常温下,稀释CH3COOH、HClO两种酸的稀溶液时,溶液pH随加水量的变化.下列说法正确的是( )
已知:25℃时某些弱酸的电离平衡常数(如表).下面图象表示常温下,稀释CH3COOH、HClO两种酸的稀溶液时,溶液pH随加水量的变化.下列说法正确的是( ) | CH3COOH | HClO | H2CO3 |
| Ka=1.8×10-5 | Ka=3.0×10-8 | Ka1=4.1×10-7 Ka2=5.6×10-11 |
| A. | 相同浓度CH3COONa和NaClO的混合液中,各离子浓度的大小关系是c(Na+)>c(ClO-)>c(CH3COO-)>c(OH-)>c(H+) | |
| B. | 向NaClO溶液中通入少量二氧化碳的离子方程式为:2ClO-+CO2+H2O═2HClO+CO32- | |
| C. | 图象中a、c两点处的溶液中$\frac{c({R}^{-})}{c(HR)•c(O{H}^{-})}$相等(HR代表CH3COOH或HClO) | |
| D. | 图象中a点酸的总浓度大于b点酸的总浓度 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 反应时间/min | n(CH3OH)/mol | n(CH3OCH3)/mo |
| 0 | 2.05 | 0 |
| t1 | 0.6 | |
| t2 | 0.05 |
| A. | 反应在t2 min时v正≠v逆 | |
| B. | 反应达到平衡时,放出的热量为50 kJ | |
| C. | 反应在t1 min内的平均速率为v(CH3OH)=$\frac{0.6}{{t}_{1}}$mol•L-1•min-1 | |
| D. | 若反应达到平衡后,缩小容器体积,$\frac{c(C{H}_{3}OC{H}_{3})}{c(C{H}_{3}OH)}$变大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分离、提纯→确定分子式→确定实验式→确定结构式 | |
| B. | 分离、提纯→确定实验式→确定分子式→确定结构式 | |
| C. | 分离、提纯→确定结构式→确定实验式→确定分子式 | |
| D. | 确定分子式→确定实验式→确定结构式→分离、提纯 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com