
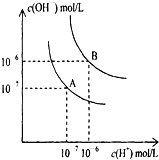
 水的电离平衡曲线如图所示.
水的电离平衡曲线如图所示. HA+OH-;在NaA溶液中,由于A-水解,导致c(Na+)>c(A-),而盐的单水解程度很小且显碱性,故水解出的c(OH-)>c(H+)且均小于c(A-),故溶液中的离子浓度的关系为:c(Na+)>c(A-)>c(OH-)>c(H+),故答案为:碱性;A-+H2O
HA+OH-;在NaA溶液中,由于A-水解,导致c(Na+)>c(A-),而盐的单水解程度很小且显碱性,故水解出的c(OH-)>c(H+)且均小于c(A-),故溶液中的离子浓度的关系为:c(Na+)>c(A-)>c(OH-)>c(H+),故答案为:碱性;A-+H2O HA+OH-;c(Na+)>c(A-)>c(OH-)>c(H+).
HA+OH-;c(Na+)>c(A-)>c(OH-)>c(H+).


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
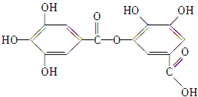
| A、它有酸性,能与纯碱溶液反应 |
| B、可以水解,其水解产物只有一种 |
| C、1 mol该有机物最多能与7 mol NaOH反应 |
| D、该有机物能发生取代反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A | |||
| B | C |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、增大 | B、减少 |
| C、不变 | D、可能增大也可能减少 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
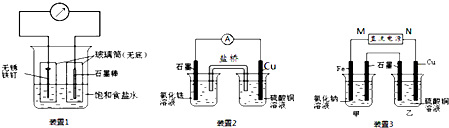
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com