
| A. | 1种 | B. | 2种 | C. | 3种 | D. | 4种 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等物质的量的N2和CO所含分子数均为NA | |
| B. | 2NA个HCl分子与44.8LH2和Cl2的混合气体所含的原子数目均为4NA | |
| C. | 32gCu将浓、稀硝酸分别还原为NO2和NO,浓、稀硝酸得到的电子数均为NA | |
| D. | 常温常压下,1mol氦气含有核外电子数为4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;
; ;
; (写出名称):苯甲醇
(写出名称):苯甲醇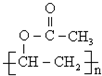 (写出单体的结构简式)CH3COOCH=CH2
(写出单体的结构简式)CH3COOCH=CH2 (写出单体的结构简式)
(写出单体的结构简式) 、HO-CH2-CH2-CH2-CH2-OH.
、HO-CH2-CH2-CH2-CH2-OH.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 797.5 kJ/mol | B. | 900.5 kJ/mol | C. | 962.5 kJ/mol | D. | 1595 kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| N2 | O2 | Ar | CO2 |
| -196°C | -183°C | -186°C | -78°C |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 天然气的主要成分是乙烯 | |
| B. | 煤焦油分馏可以获得多种芳香烃 | |
| C. | 石油的裂化和裂解都属于物理变化 | |
| D. | 天然气、沼气都属于可再生的清洁能源 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com