
����Ŀ��2.48 g��ͭ�Ͻ���ȫ�ܽ���80 mL 4.0 mol��L��1ϡ�����У��õ���״����672 mL NO����(�����ʱ�������������)������˵����ȷ����
A. ȡ��Ӧ����Һ�����뼸��KSCN��Һ����Ѫ��ɫ����
B. �úϽ�������ͭ�����ʵ���֮����1��2
C. ��Ӧ����Һ(������Һ����仯)��c(H��)��2.5 mol��L��1
D. ��Ӧ�����Һ�м���2.0 mol��L��1NaOH��Һ����������ǡ��ȫ������ʱ�������NaOH��Һ�������120 mL
���𰸡�C
��������n(HNO3)=cV=4.0mol/L��0.08L=0.32mol��n(NO)=![]() =
=![]() =0.03mol��
=0.03mol��
�ڸ�������ԭ��Ӧ������ɷֵı仯��4H��+![]() ��2H2O+NO����
��2H2O+NO����
n(H��)(�μӷ�Ӧ)=4n(NO)=0.12mol<n(HNO3)���������������
A. ���������������������ȡ��Ӧ����Һ�����뼸��KSCN��Һ������Ѫ��ɫ����A����B. ���úϽ�������ͭ�����ʵ����ֱ���xmol��ymol����������ɵã�56x+64y=2.48��3x+2y=0.09�����x=0.01��y=0.03���úϽ�������ͭ�����ʵ���֮����1��3����B����C. ��Ӧ����Һ��n(H��)(ʣ��)= n(HNO3)- n(H��)(�μӷ�Ӧ)=0.20mol��c(H��)��![]() =2.5 mol��L��1����C��ȷ��D. ��Ӧ�����Һ�м���2.0 mol��L��1NaOH��Һ���ȷ����кͷ�Ӧ���ٷ���������Ӧ������������ǡ��ȫ������ʱ���γ���������Һ���������Ƶ���ɿɵ�n(HNO3)= n(NaOH)�����Լ���NaOH��Һ�������
=2.5 mol��L��1����C��ȷ��D. ��Ӧ�����Һ�м���2.0 mol��L��1NaOH��Һ���ȷ����кͷ�Ӧ���ٷ���������Ӧ������������ǡ��ȫ������ʱ���γ���������Һ���������Ƶ���ɿɵ�n(HNO3)= n(NaOH)�����Լ���NaOH��Һ�������![]() =160 mL����D����ѡC��
=160 mL����D����ѡC��


 ���㼤�������100�ִ��Ծ�ϵ�д�
���㼤�������100�ִ��Ծ�ϵ�д� ��Ȥ������ҵ���ϿƼ�������ϵ�д�
��Ȥ������ҵ���ϿƼ�������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Һ�д��ڵ���ƽ��CH3COOH![]() H++CH3COO-��������������ȷ����
H++CH3COO-��������������ȷ����
A. �����¶ȣ�ƽ�������ƶ�������ĵ��볣��Kaֵ����
B. 0.l0mol/L��CH3COOH��Һ�м�ˮϡ�ͣ���Һ��c(OH-)����
C. CH3COOH��Һ�м�������CH3COONa���壬ƽ�������ƶ�
D. �����£���ʹ0.1mol/L������Һ��pH�������a����С���ɼ�������ˮ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��NA��ʾ�����ӵ�������ֵ�� ����������ȷ����
A. 1mol H2O�к��еļ��Թ��ۼ���ĿΪ2NA
B. 16 g16O2��18O2������к��е�������ĿΪ8NA
C. Zn��Ũ���ᷴӦ�õ�22.4LSO2�� H2�������ʱ�� ת�Ƶĵ�����Ϊ4NA
D. ��״����2 mol NO��1 mol O2��ַ�Ӧ���������2NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ijЩ���ӵļ��鼰����һ����ȷ����
A. ����ϡ���������ɫ���壬������ͨ�����ʯ��ˮ�У���Һ����ǣ�һ����CO![]()
B. �����Ȼ�����Һ�а�ɫ�����������ټ����ᣬ��������ʧ��һ����SO![]()
C. ��������������Һ�����ȣ�������������ʹʪ��ĺ�ɫʯ����ֽ������һ����NH![]()
D. ����̼������Һ������ɫ�������ټ������ɫ������ʧ��һ����Ba2��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1���ڱ�״���£����Ϊ6.72L��CO����Ϊ___��CO���ʵ���Ϊ____��CO������Ϊ____��COĦ������Ϊ____��
��2���ڱ�״���£����Ϊ8.96 L��CO��CO2�Ļ�����干14.4g��CO������Ϊ____g��CO�����Ϊ___L����������ƽ��Ħ������Ϊ___g��mol��1��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��80��ʱ��1L �ܱ������г���0.20 mol N2O4��������ӦN2O4![]() 2NO2 ��H = + Q kJ��mol��1(Q��0)������������ݣ�
2NO2 ��H = + Q kJ��mol��1(Q��0)������������ݣ�
ʱ��/s | 0 | 20 | 40 | 60 | 80 | 100 |
c(NO2)/mol��L��1 | 0.00 | 0.12 | 0.20 | 0.26 | 0.30 | 0.30 |
�����ж���ȷ����
A. �����¶ȸ÷�Ӧ��ƽ�ⳣ��K��С
B. 20��40s �ڣ�v(N2O4)= 0.004 mol��L��1��s��1
C. 100sʱ��ͨ��0.40 mol N2O4������ƽ��ʱN2O4��ת��������
D. ��Ӧ��ƽ��ʱ�����յ�����Ϊ0.15Q kJ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����б仯��Ҫ������������(����)
A. 1s22s22p63s1��1s22s22p6 B. 3s23p5��3s23p6
C. 2p![]() 2p
2p![]() 2p
2p![]() ��2p
��2p![]() 2p
2p![]() 2p
2p![]() D. 2H��H��H
D. 2H��H��H
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ijһ�¶��£�ijһ�ܱ������У�M��N��R��������Ũ�ȵı仯��ͼa��ʾ���������������䣬���¶ȷֱ�ΪT1��T2ʱ��N�����������ʱ���ϵ��ͼb��ʾ�������н�����ȷ������ ��

A���÷�Ӧ���Ȼ�ѧ����ʽ![]() ��H��0
��H��0
B���ﵽƽ����������������䣬��С���������ƽ�����淴Ӧ�����ƶ�
C���ﵽƽ����������������䣬�����¶ȣ������淴Ӧ�ٶȾ�����M��ת���ʼ�С
D���ﵽƽ����������������䣬ͨ��ϡ�����壬ƽ��һ��������Ӧ�����ƶ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����þ���仯�����ڹ�ũҵ������Ӧ�ù㷺��
I.��֪��þ����Ҫ�ɷ�Ϊ![]() ,��ɰ�Ļ�ѧʽΪ
,��ɰ�Ļ�ѧʽΪ![]() ��һ��������þ����ȡ����þ������Ĺ�������������ʾ��
��һ��������þ����ȡ����þ������Ĺ�������������ʾ��
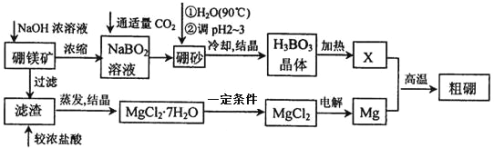
(1)д����Ԫ�������ڱ��е�λ��_________________________
(2)����ɰ������ˮ�������������Һ��![]() Ϊ23����ȡ����
Ϊ23����ȡ����![]() ,�÷�Ӧ�����ӷ���ʽΪ_________________________________________��
,�÷�Ӧ�����ӷ���ʽΪ_________________________________________��
(3)��![]() �Ʊ�
�Ʊ�![]() ʱ��һ��������_________________________________��
ʱ��һ��������_________________________________��
(4)�ƵõĴ�����һ������������![]() ,
, ![]() ���ȷֽ���Եõ������ĵ������ֽ�
���ȷֽ���Եõ������ĵ������ֽ�![]() �����Ƴɵ�
�����Ƴɵ�![]() ��ȫ�ֽ⣬�����ɵ�
��ȫ�ֽ⣬�����ɵ�![]() ���Ƴ�
���Ƴ�![]() ��Һ������ʽ�ζ�����ȡ
��Һ������ʽ�ζ�����ȡ![]() ��ˮ��Һ������ƿ�У������еμӼ��ε�����Һ����
��ˮ��Һ������ƿ�У������еμӼ��ε�����Һ����![]() ��Һ�ζ����յ㣬����
��Һ�ζ����յ㣬����![]() ��Һ
��Һ![]() ��(��ʾ��
��(��ʾ��![]() )�ζ��յ������Ϊ____________,�ô�����Ʒ�Ĵ���Ϊ____________%
)�ζ��յ������Ϊ____________,�ô�����Ʒ�Ĵ���Ϊ____________%
�� (5)��֪��![]() �ĵ��볣��Ϊ
�ĵ��볣��Ϊ![]() ,
,![]() �ĵ��볣��Ϊ
�ĵ��볣��Ϊ![]() ��
��![]() ����ʢ�б���������Һ���Թ��У��μ�
����ʢ�б���������Һ���Թ��У��μ�![]()
![]() ��Һ��_____(������������������)�۲쵽�����ݳ�.
��Һ��_____(������������������)�۲쵽�����ݳ�.
(6)![]() [Ҳ��д��
[Ҳ��д��![]() ]����ͨ�����
]����ͨ�����![]() ��Һ�ķ����Ʊ�.����ԭ����ͼ��ʾ(�����ӽ���Ĥ�������ӽ���Ĥ�ֱ�ֻ���������ӡ�������ͨ��).
��Һ�ķ����Ʊ�.����ԭ����ͼ��ʾ(�����ӽ���Ĥ�������ӽ���Ĥ�ֱ�ֻ���������ӡ�������ͨ��).
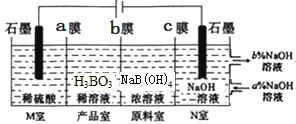
��![]() ĤΪ________����Ĥ(������������������������)��д����Ʒ�ҷ�����Ӧ�����ӷ���ʽ: ________________
ĤΪ________����Ĥ(������������������������)��д����Ʒ�ҷ�����Ӧ�����ӷ���ʽ: ________________
������ÿ����![]() ,�����ҿ�����________
,�����ҿ�����________![]() ����(��״��)
����(��״��)
��![]() ���У����ںͳ��ڵ���ҺŨ�ȴ�С��ϵΪ
���У����ںͳ��ڵ���ҺŨ�ȴ�С��ϵΪ![]() ________
________![]() (����>������<��)
(����>������<��)
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com