
 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 做银镜反应的试管先用NaOH溶液洗涤,倒掉后再用清水冲洗干净 | |
| B. | 皮肤上若沾有少量的苯酚用酒精洗 | |
| C. | 做银镜反应后的试管一般采用浓盐酸洗涤 | |
| D. | 制乙烯的实验温度计应伸入液面下 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
| 2 | ① | ② | ||||||
| 3 | ⑨ | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 +Br2→
+Br2→ ;在一定条件下,由A聚合得到的高分子化合物的结构简式为
;在一定条件下,由A聚合得到的高分子化合物的结构简式为 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
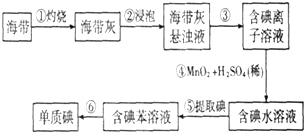
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 (或
(或
 ).
).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 共价化合物中可能有离子键 | |
| B. | 非金属原子间不可能形成离子化合物 | |
| C. | 离子化合物中可能有共价键 | |
| D. | 两个非金属原子间可能形成离子键 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com