
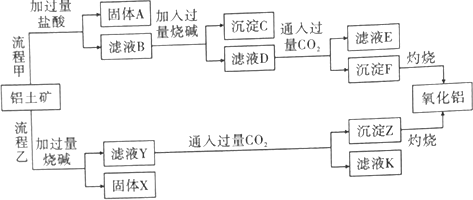
分析 (1)由工艺流程甲可知,铝土矿(主要成分是Al2O3,含SiO2、Fe2O3、MgO等杂质),铝土矿与盐酸反应得固体A为滤液B,SiO2不与盐酸反应,则固体A为SiO2,滤液B含有氯化铝、氯化铁、氯化镁等,滤液中加入过量的NaOH,可推知沉淀C为氢氧化铁、氢氧化镁,滤液D含有偏铝酸钠、氯化钠、NaOH,所以向滤液D中通入过量二氧化碳,生成氢氧化铝沉淀与碳酸氢钠,沉淀F为Al(OH)3,滤液E中含有NaCl、NaHCO3;
根据工艺流程乙可知,铝土矿中的Al2O3、SiO2能和氢氧化钠反应,可知固体X为Fe2O3、MgO等,滤液Y为硅酸钠、偏铝酸钠,滤液中通入过量二氧化碳,沉淀Z为Al(OH)3、硅酸,滤液K中含有NaHCO3,以此来解答.
(2)由于氧化铝的熔点较高,需加冰晶石降低氧化铝的熔点,降低成本;电解时生成的O2在高温时会和石墨电极发生反应,消耗石墨电极;
(3)A.依据化合物元素化合价代数和为0分析计算;
B.它用于净化水时对水的pH的改变,比相同量的AlCl3和FeCl3都大;
C.这种碱式盐可看做FeCl3、AlCl3水解的中间产物;
D.它在强酸性和强碱性溶液中都不能稳定存在.
解答 解:(1)由工艺流程甲可知,铝土矿(主要成分是Al2O3,含SiO2、Fe2O3、MgO等杂质),铝土矿与盐酸反应得固体A为滤液B,SiO2不与盐酸反应,则固体A为SiO2,滤液B含有氯化铝、氯化铁、氯化镁等,滤液中加入过量的NaOH,可推知沉淀C为氢氧化铁、氢氧化镁,滤液D含有偏铝酸钠、氯化钠、NaOH,所以向滤液D中通入过量二氧化碳,生成氢氧化铝沉淀与碳酸氢钠,沉淀F为Al(OH)3,滤液E中含有NaCl、NaHCO3;
根据工艺流程乙可知,铝土矿中的Al2O3、SiO2能和氢氧化钠反应,可知固体X为Fe2O3、MgO等,滤液Y为硅酸钠、偏铝酸钠,滤液中通入过量二氧化碳,沉淀Z为Al(OH)3、硅酸,滤液K中含有NaHCO3.
①根据工艺流程甲可知,SiO2不与盐酸反应,则固体A为SiO2;根据工艺流程乙可知,铝土矿中的Al2O3、SiO2能和氢氧化钠反应,可知固体X为Fe2O3、MgO,故答案为:SiO2;Fe2O3、MgO;
②滤液E中含有NaHCO3,其中NaHCO3可制纯碱或作发酵粉,故答案为:NaHCO3;纯碱或作发酵粉;
③滤液D含有偏铝酸钠、氯化钠、NaOH,在滤液D中通入过量CO2,发生的反应有:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-,OH-+CO2=HCO3-,
故答案为:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-;OH-+CO2=HCO3-;
(2)由于氧化铝的熔点较高,工业上电解氧化铝冶炼铝时加入冰晶石(Na3AlF6)助熔(或降低氧化铝的熔点);电解时生成的O2在高温时会和石墨电极发生反应,消耗石墨电极,所以要不断补充阳极材料(石墨),
故答案为:作助熔剂(或降低氧化铝的熔点);电解时生成的O2在高温时会和石墨电极发生反应,消耗石墨;
(3)A.阴离子总价态:6-n+n=6,铝只有+3价,所以Fe就是6-3=3,外面的m只是表示这样一个分子聚合度,与价态无关,故A错误;
B.PAFC用于净水时,氢氧根离子的存在对水的电离期待抑制作用,比用相同量的氯化铝和氯化铁对水的pH改变小,故B正确;
C.PAFC是碱式复盐可看作一定比例的氯化铁与氯化铝水解的中间产物,故C正确;
D.PAFC是碱式复盐,在强酸性和强碱性溶液中都不能稳定存在,故D错误;
故答案为:BC.
点评 本题以氧化铝提取工艺流程为载体考查混合物分离实验方案的设计,为高频考点,涉及无机物推断、元素化合物性质及相互转化、除杂的方法、离子方程式等,侧重分析与实验能力的考查,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 盐酸中的c(Cl-)与醋酸溶液中的c(CH3COO-)相等 | |
| B. | 分别与足量CaCO3反应,放出的CO2一样多 | |
| C. | 分别用水稀释相同倍数,n(Cl-)<n(CH3COO-) | |
| D. | 分别将两溶液升温至80℃,醋酸溶液的pH变小,盐酸的pH不变(不考虑挥发) |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ②③ | C. | ①④ | D. | ③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 向氯化铝溶液中加入过量氨水:Al3++4OH-=AlO2-+2H2O | |
| B. | 金属钠与水反应:Na+H2O=Na++OH-+H2↑ | |
| C. | Ba(OH)2溶液中滴加少量NH4HCO3溶液:NH4++HCO3-+2OH-+Ba2+=NH3•H2O+H2O+BaCO3↓ | |
| D. | 用铁棒作阴极、炭棒作阳极电解饱和氯化钠溶液:2C1-+2H2O $\frac{\underline{\;电解\;}}{\;}$ H2↑+Cl2↑+2OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | l00mL0.4 mol•L-1KNO3溶液 | B. | 100mL0.2mol•L-1Cu(NO3)2溶液 | ||
| C. | 200mLO.l mol•L-1Fe(NO3)2溶液 | D. | 400mLO.l mol•L-1Al(NO3)3溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com