
| A. | 金属腐蚀就是金属原子失去电子被还原的过程 | |
| B. | 可将地下输油钢管与外加直流电的正极相连以保护它不受腐蚀 | |
| C. | 自然界中钢铁的腐蚀以析氢腐蚀为主 | |
| D. | 生铁在海水中的腐蚀速度比在空气中快 |
分析 A、金属失电子化合价升高被氧化;
B、外加直流电源的正极相连的金属作阳极,该电极金属易被腐蚀;
C、自然界中钢铁的腐蚀以吸氧腐蚀为主;
D、海水中含有较多的电解质,易发生电化学腐蚀.
解答 解:A、金属腐蚀就是金属原子失电子化合价升高被氧化的过程,故A错误;
B、地下输油钢管与外加直流电源的正极相连,此时该金属作阳极,该电极金属易被腐蚀,故B错误;
C、自然界中钢铁的表面易形成弱酸性或中性环境,易发生吸氧腐蚀,所以钢铁的腐蚀以吸氧腐蚀为主,故C错误;
D、海水中含有较多的电解质,易发生电化学腐蚀,所以生铁在海水中的腐蚀速度比在空气中快,故D正确.
故选D.
点评 本题以金属的腐蚀为载体考查了原电池和电解池的工作原理,难度不大,原电池中负极上金属容易被腐蚀,正极上金属被保护.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | PbO2是电池的负极 | B. | 负极的电极反应式为:Pb-2e-=Pb2+ | ||
| C. | Pb得电子,发生氧化反应 | D. | 电池充电时,溶液酸性增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C2H4(g)+3O2(g)═2CO2(g)+2H2O(l)△H=-2b kJ•mol-1 | |
| B. | C2H4(g)+3O2(g)═2CO2(g)+2H2O(l)△H=+2b kJ•mol-1 | |
| C. | $\frac{1}{4}$C2H4(g)+$\frac{3}{4}$O2(g)═$\frac{1}{2}$CO2(g)+$\frac{1}{2}$H2O(l)△H=+b kJ•mol-1 | |
| D. | C2H4(g)+3O2(g)═2CO2(g)+2H2O(l)△H=-4b kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
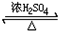 CH3COOC2H5+H2O、酯化反应(取代反应).
CH3COOC2H5+H2O、酯化反应(取代反应).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

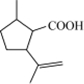 .
.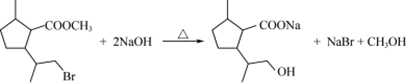 .
.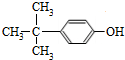 .
.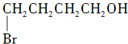 制备
制备  的合成路线图(无机试剂任选).合成路线流程图示例如下:CH2═CH2 $\stackrel{HBr}{→}$CH3CH2Br$→_{△}^{NaOH}$CH3CH2OH.
的合成路线图(无机试剂任选).合成路线流程图示例如下:CH2═CH2 $\stackrel{HBr}{→}$CH3CH2Br$→_{△}^{NaOH}$CH3CH2OH.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标况下,44.8 L的水中含有H2O分子的数目为2 NA | |
| B. | 常温常压下,22.4 L氢气中含氢原子数目为2 NA | |
| C. | 物质的量浓度为0.5 mol/L的NaCl溶液中,含有Cl-个数为0.5 NA | |
| D. | 5.6 g Fe在足量氯气中完全反应,失去的电子数为0.3 NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com