
【题目】图1是元素周期表的一部分,A、B、C、D、E、X 是元素周期表给出元素组成的常见单质或化合物.已知 A、B、C、D、E、X 存在如图2所示转化关系(部分生成物和反应条件略去). 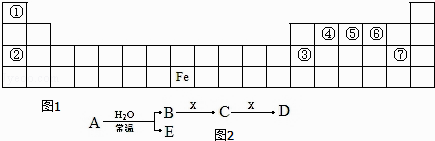
(1)若 E 为氧化物,则 A 与水反应的方程式为 , 该反应中氧化剂和还原剂物的量之比为 . ①当 X 为碱性盐溶液,C分子中有 22 个电子时,D 是(写化学式).
②当 X 为金属单质时,X 与足量 B 的稀溶液反应生成 C 的离子方程式为 , 写出检验生成物 C 的阳离子所用试剂的电子式 .
(2)若 E 为单质气体,D 为白色沉淀,A 可能是(写化学式),X是(写化学式).
【答案】
(1)3NO2+H2O═2HNO3+NO;1:2;NaHCO3;Fe+4H++NO3﹣═Fe3++NO↑+2H2O;![]()
(2)Na、Na2O2等;AlCl3或Al(NO3)3
【解析】解:由元素在周期表中的位置可知,①为H元素,②为Na元素,④为C元素,⑤为N元素,⑥为O元素,③为Al,⑦为Cl元素.(1)若E为氧化物,根据转化关系以及元素种类可知,则A为NO2 , B为硝酸,NO2与水反应生成硝酸和一氧化氮,其反应为3NO2+H2O═2HNO3+NO.该反应中氧化剂是NO2 , 还原剂是NO2 , 氧化剂与还原剂的物质的量之比为1:2, 所以答案是:3NO2+H2O═2HNO3+NO;1:2;
①C 分子中有 22 个电子时,C为二氧化碳,X为碳酸盐,硝酸与碳酸盐反应生成二氧化碳,CO32﹣离子水解CO32﹣+H2OHCO3﹣+OH﹣使X液呈碱性,二氧化碳与碳酸钠反应生成D为NaHCO3 ,
所以答案是:NaHCO3;②X为金属单质时,由转化图可知,应为Fe与稀硝酸反应生成硝酸铁,X与B的稀溶液反应生成C的离子方程式为Fe+4H++NO3﹣═Fe3++NO↑+2H2O,检验生成物 C 的阳离子所用试剂为KSCN,电子式为 ![]() ,
,
所以答案是:Fe+4H++NO3﹣═Fe3++NO↑+2H2O; ![]() ;(2)由转化关系以及元素种类,若E为单质气体,则E为氢气或氧气,A为Na或Na2O2等,B为NaOH,D为白色沉淀,D为Al(OH)3 , 由B
;(2)由转化关系以及元素种类,若E为单质气体,则E为氢气或氧气,A为Na或Na2O2等,B为NaOH,D为白色沉淀,D为Al(OH)3 , 由B ![]() C
C ![]() D,可以推知X为铝盐[AlCl3 或 Al(NO3)3],C为偏铝酸盐,C与X反应的离子反应为3AlO2﹣+Al3++6H2O═4Al(OH)3↓,
D,可以推知X为铝盐[AlCl3 或 Al(NO3)3],C为偏铝酸盐,C与X反应的离子反应为3AlO2﹣+Al3++6H2O═4Al(OH)3↓,
所以答案是:Na、Na2O2等;AlCl3 或 Al(NO3)3 .


科目:高中化学 来源: 题型:
【题目】下列实验操作或结论正确的是
A.分液时,先将上层液体倒出
B.将烧杯中刚溶解的氢氧化钠溶液立即转移到容量瓶中
C.粗盐经溶解、过滤、蒸发结晶得到的食盐中,仍含有Mg2+、Ca2+、SO42-等杂质
D.制取蒸馏水时,冷却水应由冷凝器的上口通入,下口流出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫化氢的转化是资源利用和环境保护的重要研究课题.由硫化氢获得硫单质有多种方法. 
(1)将烧碱吸收H2S后的溶液加入到如图1所示的电解池的阳极区进行电解.电解过程中阳极区发生如下反应:S2-﹣2e﹣═S (n﹣1)S+S2﹣═Sn2﹣①写出电解时阴极的电极反应式: .
②电解后阳极区的溶液用稀硫酸酸化得到硫单质,其离子方程式可写成
(2)将H2S和空气的混合气体通入FeCl3、FeCl2、CuCl2的混合溶液中反应回收S,其物质转化如图2所示. ①在图示的转化中,化合价不变的元素是 .
②反应中当有1mol H2S转化为硫单质时,保持溶液中Fe3+的物质的量不变,需消耗O2的物质的量为 .
③在温度一定和不补加溶液的条件下,缓慢通入混合气体,并充分搅拌.欲使生成的硫单质中不含CuS,可采取的措施有 .
(3)H2S在高温下分解生成硫蒸气和H2 . 若反应在不同温度下达到平衡时,混合气体中各组分的体积分数如图3所示,H2S在高温下分解反应的化学方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列无色透明溶液,能大量共存的是( )
A. K+、Na+、Ba2+、OH— B. Cl—、MnO4—、K+、Na+
C. Ag+、K+、Cl—、NO3— D. H+、NO3—、CO32—、Fe2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列项目判断,结论正确的是( )
选项 | 项目 | 结论 |
A | 三种有机化合物:乙烷、氯乙烯、苯 | 分子内所有原子均在同一平面上 |
B | C4H8Cl2的同分异构体数目(不考虑立体异构) | 共有10种 |
C | 乙烯和苯都能使溴水褪色 | 褪色的原理相同 |
D | 由乙酸和乙醇制乙酸乙酯,油脂水解 | 均属于取代反应 |
A.A
B.B
C.C
D.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是重要的绿色能源之一,目前科学家用水煤气(CO+H2)合成甲醇,其反应为:CO(g)+2H2(g) ![]() CH3OH(g),△H=﹣128.1kJmol﹣1 , 回答下列问题:
CH3OH(g),△H=﹣128.1kJmol﹣1 , 回答下列问题:
(1)该反应是可逆反应,为使化学反应速率和CO的转化率都同时提高的措施有(写两条).
(2)恒温恒容条件能说明该可逆反应达平衡的是;
A.2v正(H2)=v逆(CH3OH)
B.n(CO):n(H2):n(CH3OH)=1:2:1
C.混合气体的密度不变
D.混合气体的平均相对分子质量不变
(3)若上述可逆反应在恒温恒容的密闭容器进行,起始时间向该容器中冲入1molCO(g)和2molH2(g).实验测得H2的平衡转化率随温度(T)、压强(P)的变化如图所示.
①该反应的△S0,图中的T1T2(填“<”“>”或“=”)
②T1下到达平衡状态A时,容器的体积为2L,此时该反应的平衡常数为 , 若达到平衡状态B时,则容器的体积V(B)=L.
(4)已知:H2(g)燃烧热△H=﹣285.8KJmol﹣1、和CO(g)燃烧热△H=﹣283.0KJmol﹣1 , 则CH3OH(g)燃烧热的热化学方程式是为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,△H1=﹣393.5kJmol﹣1 , △H2=﹣395.4kJmol﹣1 , 下列说法或表示式正确的是( ) 
A.C(s、石墨)═C(s、金刚石)△H=﹣1.9 kJmol﹣1
B.石墨和金刚石的转化是物理变化
C.石墨的稳定性强于金刚石
D.1 mol石墨的总键能比1 mol金刚石的总键能小1.9 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列是几种原子的基态电子排布,电负性最大的原子是( )
A.1s22s22p4
B.1s22s22p63s23p3
C.1s22s22p63s23p2
D.1s22s22p63s23p64s2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数值,下列说法正确的是( )
A.1 mol Cl2分别与足量的铁或氢氧化钠溶液反应,转移电子数均为2NA
B.将NA个NH3分子溶于1 L水中得到1 molL﹣1的氨水
C.标准状况下,22.4 L氮气与22.4 L苯所含分子数均为 NA
D.常温常压下,32gO2、O3的混合物含有2NA个氧原子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com