
 原子序数小于36的X、Y、Z、W、R五种元素,原子序数依次增大.五种元素中,仅R为金属元素,其原子序数为27.X价电子排布式为nsnnpn,元素Z基态原子s电子总数与p电子总数相等,W与其它四种元素能层数不同,且未成对电子数目为1个.
原子序数小于36的X、Y、Z、W、R五种元素,原子序数依次增大.五种元素中,仅R为金属元素,其原子序数为27.X价电子排布式为nsnnpn,元素Z基态原子s电子总数与p电子总数相等,W与其它四种元素能层数不同,且未成对电子数目为1个.分析 原子序数小于36的X、Y、Z、W、R五种元素,原子序数依次增大,五种元素中,仅R为金属元素,其原子序数为27,则R为Co元素;X价电子排布式为nsnnpn,n=2,则X的电子排布式为2s22p2,X为C元素;元素Z基态原子s电子总数与p电子总数相等,则Z的电子排布式只能为1s22s22p2,为O元素;结合Y的原子序数可知Y为N元素;W与其它四种元素能层数不同,且未成对电子数目为1个,Y只能位于第三周期,为Cl元素,据此进行解答.
解答 解:原子序数小于36的X、Y、Z、W、R五种元素,原子序数依次增大,五种元素中,仅R为金属元素,其原子序数为27,则R为Co元素;X价电子排布式为nsnnpn,n=2,则X的电子排布式为2s22p2,X为C元素;元素Z基态原子s电子总数与p电子总数相等,则Z的电子排布式只能为1s22s22p2,为O元素;结合Y的原子序数可知Y为N元素;W与其它四种元素能层数不同,且未成对电子数目为1个,Y只能位于第三周期,为Cl元素,
(1)R的原子序数为27,其基态原子核外电子总数为27,其核外电子排布式为:1s22s22p63s23p63d74s2,
故答案为:1s22s22p63s23p63d74s2;
(2)[R(XY)6]4-为[Co(CN)6]4-,[Co(CN)6]4-中CN-与Co之间有6个配位键,在每个CN-内部有一个σ键,所以1mol该配合物中含有σ键的数目为12NA(或12×6.02×1023),
故答案为:12mol或12×6.02×1023;
(3)XZW2为COCl2,与甲醛结构相似,则其分子中含有1个碳氧双键和2个C-Cl单键,其中心原子C采用sp2杂化;
由于COCl2的相对分子质量比甲醛大,则范德华力比甲醛大,导致其其沸点高于甲醛,
故答案为:sp2;因为COCl2的相对分子质量比甲醛大,故范德华力比甲醛大,导致其沸点比甲醛高;
(4)NCl3的分子中N原子形成3个N-Cl键,含有1对孤电子对,故其立体构型为三角锥形,
故答案为:三角锥形;
(5)晶胞中R原子数目为1+8×$\frac{1}{8}$=2,A原子数目为4,由图可知R的配位数是4,则A的配位数是4×$\frac{2}{4}$=2,
故答案为:4;2;
(6)白色球与周围的4个黑色球形成正四面体结构.利用平移法在图中画出与顶点m配位的所有A原子为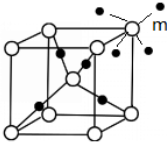 ,
,
故答案为: .
.
点评 本题是对物质结构与性质的考查,涉及核外电子排布、配合物、杂化方式与空间构型、分子结构与性质、晶胞结构与计算等,需要学生具备一定的空间想象与分析计算能力.


科目:高中化学 来源: 题型:填空题
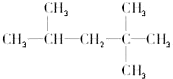 现有化合物A是汽油燃烧抗震性能的参照物,它的结构式如图:
现有化合物A是汽油燃烧抗震性能的参照物,它的结构式如图:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
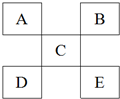
| A. | 如果D是金属元素,那么D元素的金属性比C强 | |
| B. | 元素C的最高价氧化物对应的水化物一定是强酸 | |
| C. | 元素B与氢形成的化合物中只能存在极性共价键 | |
| D. | 若E为非金属,则E的非金属性要强于B |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验目的 | 实验方案 | |
| A | 证明溴乙烷发生消去反应有乙烯生成 | 向试管中加入适量的溴乙烷和NaOH的乙醇溶液,加热,将反应产生的气体通入溴的四氯化碳溶液 |
| B | 证明Mg(OH)2沉淀可以转化为Fe(OH)3沉淀 | 向1mL 1mol/L NaOH溶液中先加入3滴1mol/L MgCl2溶液,再加入3滴1mol/L FeCl3溶液 |
| C | 除去甲烷中的乙烯 | 将混合气通入溴水洗气 |
| D | 探究温度对化学平衡的影响 | 将NO2球浸泡在冷、热水中,观察颜色的变化 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 所得溶液中c(Cu2+)=0.225mol/L | |
| B. | 所得溶液中c(Cu2+)=0.03mol/L | |
| C. | 所得气体在标准状况下的体积为0.448L | |
| D. | 反应中转移0.06mol的电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳氢化合物的通式为CnH2n+2 | |
| B. | 石油的主要成分是碳氢化合物 | |
| C. | 乙炔是含碳量最高的碳氢化合物 | |
| D. | 分子式为C4H10的烃有三种同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com