
 一种石英晶体的晶胞结构如图所示,可以看成是在晶体硅的晶胞中每两个硅原子间插入一个氧原子而得到.其中硅原子的配位数为4;若该晶胞的晶胞参数为a pm,则该晶体的密度为$\frac{480}{{N}_{A}(a×1{0}^{-10})^{3}}$g/cm3(以含a、NA的代数式表示).
一种石英晶体的晶胞结构如图所示,可以看成是在晶体硅的晶胞中每两个硅原子间插入一个氧原子而得到.其中硅原子的配位数为4;若该晶胞的晶胞参数为a pm,则该晶体的密度为$\frac{480}{{N}_{A}(a×1{0}^{-10})^{3}}$g/cm3(以含a、NA的代数式表示). 分析 由图可知,Si位于顶点、面心和体内,O原子均位于体内,由体内Si与4个O原子形成正四面体可知Si的周围有4个O原子;Si原子数为8×$\frac{1}{8}$+6×$\frac{1}{2}$+4=8,Si与O形成4个正四面体体,O原子为4×4=16个,即晶胞含4个SiO2,结合ρ=$\frac{m}{V}$计算.
解答 解:由图可知,Si位于顶点、面心和体内,O原子均位于体内,由体内Si与4个O原子形成正四面体可知Si的周围有4个O原子,则硅原子的配位数为4;
Si原子数为8×$\frac{1}{8}$+6×$\frac{1}{2}$+4=8,Si与O形成4个正四面体体,O原子为4×4=16个,即晶胞含8个SiO2,晶胞参数为a pm,体积为(a×10-10cm)3,则该晶体的密度为$\frac{m}{V}$=$\frac{\frac{8×60}{{N}_{A}}g}{(a×1{0}^{-10}cm)^{3}}$=$\frac{480}{{N}_{A}(a×1{0}^{-10})^{3}}$g/cm3,
故答案为:4;$\frac{480}{{N}_{A}(a×1{0}^{-10})^{3}}$.
点评 本题考查晶胞计算,为高频考点,把握原子的位置、均摊法计算、质量与密度关系为解答的关键,侧重分析与计算能力的考查,注意均摊法应用,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | Cl-、Na+、NO3-、Ca2+ | B. | NH4+、HCO3-、Cl-、K+ | ||
| C. | K+、Fe2+、Cl-、NO3- | D. | Cu2+、NH4+、I-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | H+透过质子交换膜由右向左移动 | |
| B. | 铜电极应与X相连接 | |
| C. | M电极的反应式:H2NCONH2+H2O-6e-═CO2↑+N2↑+6H+ | |
| D. | 当N电极消耗0.5 mol气体时,则铁电极增重32 g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 该方法将电能转化成化学能 | |
| B. | 在此装置中钢管道作正极 | |
| C. | 该方法称为“外加电流的阴极保护法” | |
| D. | 镁块上发生的电极反应为O2+2H2O+4e-═4OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(Na+)>c(HRO3-)>c(H+)>c(RO32-)>c(OH-) | B. | c(Na+)+c(H+)=c(HRO3-)+2c(RO3-)+c(OH-) | ||
| C. | c(Na+)=c(HRO3-)+(H2RO3)+2c(RO32-) | D. | 以上都不正确 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
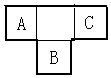 A、B、C为短周期元素,在周期表中所处的位置如图所示,A、C两元素的原子核外电子数之和等于B原子的质子数,B原子核内质子数和中子数相等.且含B元素物质的大量燃烧是形成酸雨的主要原因之一.
A、B、C为短周期元素,在周期表中所处的位置如图所示,A、C两元素的原子核外电子数之和等于B原子的质子数,B原子核内质子数和中子数相等.且含B元素物质的大量燃烧是形成酸雨的主要原因之一.  ,用电子式表示元素B的钠盐的形成过程:
,用电子式表示元素B的钠盐的形成过程: .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硒化氢(H2Se)是有毒的气体,比H2S稳定 | |
| B. | 砹为有色固体,HAt不稳定 | |
| C. | 硫酸锶(SrSO4)是难溶于水的白色固体 | |
| D. | 铍(Be)的氧化物的水化物可能具有两性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 次氯酸的结构式:H-Cl-O | |
| B. | CO2的结构式:C=O=O | |
| C. | 用电子式表示氯化氢分子的形成过程: | |
| D. | 硫离子的结构示意图: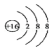 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com