
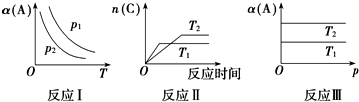
| A. | 在图象反应Ⅰ中,说明正反应为吸热反应 | |
| B. | 在图象反应Ⅰ中,若p1>p2,则此反应的△S>0 | |
| C. | 在图象反应Ⅱ中,说明该正反应为吸热反应 | |
| D. | 在图象反应Ⅲ中,若T1>T2,则该反应能自发进行 |
分析 A.根据图1知,同一压强下,升高温度,A的转化率降低,说明平衡逆向移动,则正反应是放热反应;
B.如果p1>p2,相同温度下,增大压强,平衡向气体体积减小的方向移动,A的转化率增大,说明平衡正向移动,则a+1>c;
C.根据图2知,T1>T2,升高温度,C的物质的量减少,则平衡逆向移动,升高温度平衡向吸热反应方向移动;
D.根据图3知,增大压强,A的转化率不变,说明反应前后气体计量数之和相等;若T1>T2,升高温度,A的转化率降低,正反应是放热反应,如果△G=△H-T△S<0,则该反应能自发进行.
解答 解:A.根据图1知,同一压强下,升高温度,A的转化率降低,说明平衡逆向移动,所以逆反应是吸热反应,则正反应是放热反应,故A错误;
B..如果p1>p2,相同温度下,增大压强,平衡向气体体积减小的方向移动,A的转化率增大,说明平衡正向移动,则a+1>c,所以正反应是熵减的反应,故B错误;
C.根据图2知,T1>T2,升高温度,C的物质的量减少,则平衡逆向移动,升高温度平衡向吸热反应方向移动,则正反应是放热反应,故C错误;
D.根据图3知,增大压强,A的转化率不变,说明反应前后气体计量数之和相等,则a+1=c,则反应前后熵不变;若T1>T2,升高温度,A的转化率降低,正反应是放热反应,所以焓变小于0,如果△G=△H-T△S<0,所以该反应能自发进行,故D正确;
故选D.
点评 本题考查图象分析,侧重考查学生分析判断能力,明确纵横坐标及曲线变化趋势含义是解本题关键,会利用吉布斯自由能判断反应的自发性,题目难度不大.


 王后雄学案教材完全解读系列答案
王后雄学案教材完全解读系列答案 海淀课时新作业金榜卷系列答案
海淀课时新作业金榜卷系列答案 期末金牌卷系列答案
期末金牌卷系列答案 轻松课堂标准练系列答案
轻松课堂标准练系列答案科目:高中化学 来源: 题型:选择题
| A. | 1molH2燃烧放出的热量为H2的燃烧热 | |
| B. | Na2SO3和H2O2的反应为氧化还原反应 | |
| C. | 若某反应的反应物总能量低于生成物总能量,则该反应为放热反应 | |
| D. | BaSO4的水溶液不导电,故BaSO4是弱电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=0的溶液中:ClO-、Cu2+、SO42-、K+ | |
| B. | 使pH试纸变红色的溶液中:Fe2+、I-、NO3-、Cl- | |
| C. | 能够和金属镁反应放出气体的溶液中:Na+、H+、SO42-、Cl- | |
| D. | 常温下,水电离出的c(H+)与c(OH-)乘积为10-28的溶液中:K+、Na+、HS-、Ca2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | C | N | O | Ne | ||||
| 3 | Na | Mg | Al | Si | S | Cl |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
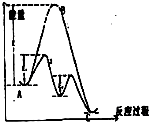
| A. | 使用正催化剂能够加快反应的速率,根本上是由于催化剂参与反应,并且同等程度地降低了正逆反应的活化能 | |
| B. | 2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑△H>0,该反应过程可用该图象表示 | |
| C. | 使用催化剂不仅能加快反应速率,而且可以让不可能发生的反应发生,如利用催化技术处理汽车尾气:2CO+2NO═2CO2+N2 | |
| D. | 化学反应的本质是旧键断裂,新键形成,如图可知反应的能量变化由旧键断裂释放的能量和新键形成吸收的能量大小决定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有①② | B. | 只有①③ | C. | 只有②③ | D. | 只有①④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com