
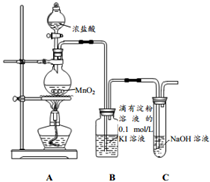
 探究氯气与KI溶液的反应,某课外小组用如图装置进行实验(夹持仪器已略去,气密性已检验)
探究氯气与KI溶液的反应,某课外小组用如图装置进行实验(夹持仪器已略去,气密性已检验)| 实验操作 | 实验现象 |
| 打开A中分液漏斗活塞,放下部分浓盐酸,加热 | 装置B中溶液变蓝色,随后蓝色褪去,溶液显浅棕色 |
| 实验操作 | 实验现象 |
| Ⅰ.取反应后B中的溶液4mL分成两等份,第一份滴入1滴碘水;第二份滴入淀粉溶液 | 第一份溶液蓝色 第二份溶液颜色没有变化 |
| Ⅱ.将I2溶于KI溶液中配制得碘总浓度为0.1mol/L的溶液,取上述溶液2mL,滴加1滴淀粉溶液,再通入氯气 | 加淀粉后溶液变蓝,通氯气后蓝色褪去,溶液显浅棕色 |
| Ⅲ.向Ⅱ所得溶液继续通入氯气 | 溶液几乎变为无色 |
分析 A装置:用浓盐酸和二氧化锰加热制取氯气,B装置中盛放淀粉碘化钾溶液,探究氯气与KI溶液的反应,氯气有毒,不能直接排放到空气中,用盛有NaOH溶液的C装置吸收氯气.
(1)实验室用浓盐酸和二氧化锰加热制取氯气,浓盐酸和二氧化锰反应生成氯化锰和氯气、水;
(2)氯气有毒,不能排放到空气中,用碱液吸收,氯气与NaOH反应生成氯化钠和次氯酸钠和水,据此书写离子方程式;
(3)根据氧化剂的氧化性大于氧化产物的氧化性,并检验产物碘,碘单质与淀粉作用显示蓝色;
(4)①根据碘单质与淀粉作用显示蓝色,分析第一份滴入1滴碘水,证明淀粉是否存在,根据I3-显棕黄色且遇淀粉变蓝,分析第二份滴入淀粉溶液的作用;
②ICl2-中的碘为+1价,氯气具有氧化性,两者反应生成+5价的碘和-1价的氯,根据得失电子守恒和电子守恒解答;
③B中溶液颜色变成浅棕色的原因是I-先被氯气氧化成I2,I2又被氯气氧化成ICl2-(红色)和ICl4-(黄色),两者混合呈浅棕色溶液.
解答 解:A装置:用浓盐酸和二氧化锰加热制取氯气,B装置中盛放淀粉碘化钾溶液,探究氯气与KI溶液的反应,氯气有毒,不能直接排放到空气中,用盛有NaOH溶液的C装置吸收氯气.
(1)实验室用浓盐酸和二氧化锰加热制取氯气,反应方程式为MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,
故答案为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;
(2)氯气有毒,污染环境,所以不能直接排空;氯气能和氢氧化钠反应被吸收,2NaOH+Cl2 =NaCl+NaClO+H2O,所以可用氢氧化钠溶液吸收多余的氯气,防止污染环境,离子方程式为:Cl2+2OH-=Cl-+ClO-+H2O;
故答案为:吸收多余氯气,防止污染环境;Cl2+2OH-=Cl-+ClO-+H2O;
(3)因Cl2的氧化性大于I2的氧化性,根据氧化剂的氧化性大于氧化产物的氧化性,可发生:Cl2+2I-=I2+2Cl-,I2能使淀粉变蓝,即B装置中通氯气后溶液变蓝,
故答案为:B装置中通氯气后溶液变蓝;
(4)①第一份滴入1滴碘水,碘单质与淀粉作用显示蓝色,证明反应后的B溶液中有淀粉,I3-显棕黄色且遇淀粉变蓝,第二份滴入淀粉溶液,溶液颜色没有变化,说明溶液的浅棕色不是I3-造成的,无I3-,
故答案为:证明反应后的B溶液中有淀粉,无I3-,说明溶液的浅棕色不是I3-造成的;
②ICl2-中的碘为+1价,氯气具有氧化性,两者反应生成IO3-,失去4e-,生成Cl-,得到2e-,最小公倍数为4,所以离子反应式为:ICl2-+2Cl2+3H2O=IO3-+6Cl-+6H+,
故答案为:ICl2-+2Cl2+3H2O=IO3-+6Cl-+6H+;
③向Ⅱ所得溶液继续通入氯气,溶液几乎变为无色,被氧化成IO3-(无色),B中溶液颜色变成浅棕色的原因是I-先被氯气氧化成I2,Cl2+2I-=I2+2Cl-,I2又被氯气氧化成ICl2-(红色)和ICl4-(黄色),两者混合呈浅棕色溶液,
故答案为:I-先被氯气氧化成I2,I2又被氯气氧化成ICl2-(红色)和ICl4-(黄色),两者混合呈浅棕色溶液.
点评 本题考查了制取氯气实验相关内容的探究,注意实验装置的用途和反应原理,把握物质的主要性质,注意题干信息的应用,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | SiO2、CsCl、CF4、CBr4 | B. | CsCl、SiO2、CBr4、CF4 | ||
| C. | SiO2、CsCl、CBr4、CF4 | D. | CF4、CBr4、CsCl、SiO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 化学式 | 电离常数(25℃) |
| CH3COOH | Ka=1.8×10-5 |
| H2SO3 | Ka1=1.23×10-2 Ka2=6.6×10-8 |
| NH3.H2O | Kb=1.8×10-5 |
| A. | 25℃时,pH=3的醋酸和pH=11的氨水等体积混合后,混合液中水的电离是被促进的 | |
| B. | Na2SO3溶液中滴加足量醋酸,反应的离子方程式为:SO32-+2CH3COOH=SO2↑+H2O+2CH3COO- | |
| C. | NaHSO3溶液呈酸性,是因为Kw/Ka1>Ka2 | |
| D. | 0.1mol/L的CH3COOH溶液与等浓度等体积的CH3COONa混合后,溶液中的微粒存在以下关系:c(H+)+c(CH3COOH)=c(CH3COO-)+2c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在过渡元素中,可以找到半导体材料 | |
| B. | 在ⅠA、ⅡA族元素中,寻找制造农药的主要元素 | |
| C. | 在金属与非金属的交界处,寻找耐高温、耐腐蚀的合金材料 | |
| D. | 为元素性质的系统研究提供指导,为新元素的发现提供线索 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
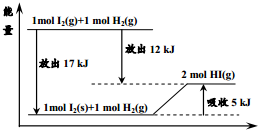
| A. | 1mol固态碘与1molH2化合生成2molHI气体时,需要吸收5kJ的能量 | |
| B. | 2molHI气体分解生成1mol碘蒸气与1molH2时需要吸收12kJ的能量 | |
| C. | 1mol固态碘变为1mol碘蒸气时需要吸收17kJ的能量 | |
| D. | 碘蒸气与H2生成HI气体的反应是吸热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 能使甲基橙变红的溶液:Mg2+、Na+、NO3-、Cl- | |
| B. | 0.1mol•L-1NH4Cl溶液:K+、Ba2+、OH-、CO32- | |
| C. | 0.1mol•L-1Fe(NO3)2溶液:H+、Al3+、SO42-、I- | |
| D. | 由水电离产生的c(H+)=10-12mol•L-1的溶液:NH4+、SO42-、HCO3-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向1mL1%的NaOH溶液中加入2mL2%的CuSO4溶液,振荡后再加入0.5mL有机物X,加热后未出现砖红色沉淀,说明X结构中不含有醛基 | |
| B. | 室温下向苯和少量苯酚的混合溶液中加入适量浓溴水,振荡、静置后过滤,可除去苯中少量苯酚 | |
| C. | 向无色的淀粉KI溶液中滴加少量氯水,溶液变成蓝色,说明氧化性:Cl2>I2 | |
| D. | 向含酚酞的氢氧化钠溶液中加入少量30%H2O2溶液,红色褪去,向褪色后的溶液再补加NaOH溶液,不显红色,说明H2O2因显酸性而使溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
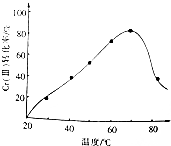 工业含铬废水的处理原理是将Cr2O72-转化为Cr3+,再将Cr3+转化为Cr(OH)3沉淀,利用硫酸工业废气中的SO2处理含铬废水,既充分利用资源、以废治废,还能节约生产成本.
工业含铬废水的处理原理是将Cr2O72-转化为Cr3+,再将Cr3+转化为Cr(OH)3沉淀,利用硫酸工业废气中的SO2处理含铬废水,既充分利用资源、以废治废,还能节约生产成本.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com