
| A. | 在pH=11的溶液中,K+、Cl-、HSO3-、Na+可以大量共存 | |
| B. | 在pH=0的溶液中,Na+、NO3-、Fe2+、K+可以大量共存 | |
| C. | 常温下,由0.1 mol•L-1一元碱BOH溶液的pH=10,可知BOH溶液中存在BOH?B++OH- | |
| D. | 常温下,由0.1 mol•L-1一元酸HA溶液的pH=3,可推知NaA溶液中存在A-+H2O=HA+OH- |
分析 A.p=11的溶液呈碱性,亚硫酸氢根离子与氢氧根离子反应;
B.酸性条件下硝酸根离子能够氧化亚铁离子;
C.常温下,由0.1 mol•L-1一元碱BOH溶液的pH=10,氢氧根离子浓度为0.0001mol/L,说明BOH在溶液中不能完全电离;
D.常温下,由0.1 mol•L-1一元酸HA溶液的pH=3,说明HA为弱电解质,则A-的水解反应应该用可逆号.
解答 解:A.该溶液呈碱性,溶液中存在大量氢氧根离子,HSO3-与氢氧根离子反应,在溶液中不能大量共存,故A错误;
B.pH=0的溶液为酸性溶液,NO3-、Fe2+在酸性条件下能够发生氧化还原反应,在溶液中不能大量共存,故B错误;
C.常温下,由0.1 mol•L-1一元碱BOH溶液的pH=10<13,说明BOH为弱电解质,在溶液中部分电离出氢氧根离子,其电离方程式为:BOH?B++OH-,故C正确;
D.常温下,由0.1 mol•L-1一元酸HA溶液的pH=3>1,说明HA为弱酸,A-的水解反应为可逆反应,应该用可逆号,NaA正确的水解反应为:A-+H2O?HA+OH-,故D错误;
故选C.
点评 本题考查离子共存的判断、弱电解质的电离,为高考的高频题,题目难度中等,注意掌握确离子不能大量共存的一般情况,明确弱电解质的电离特点,试题培养了学生的分析能力及灵活应用能力.


 出彩同步大试卷系列答案
出彩同步大试卷系列答案科目:高中化学 来源: 题型:选择题
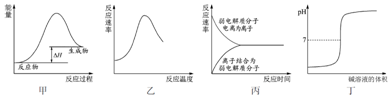
| A. | 图甲表示燃料燃烧反应的能量变化 | |
| B. | 图乙表示酶催化反应的反应速率随反应温度的变化 | |
| C. | 图丙表示弱电解质在水中建立电离平衡的过程 | |
| D. | 图丁表示强碱滴定强酸的滴定曲线 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
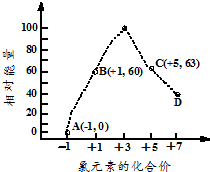 填写下列空白:
填写下列空白: .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
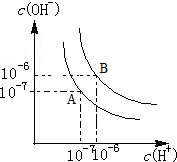 水的电离平衡如图所示.
水的电离平衡如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=-1 068 kJ/mol | |
| B. | 肼是与氨类似的弱碱,它易溶于水,其电离方程式:N2H4+H2O═N2H5++OH- | |
| C. | 铂做电极,以KOH溶液为电解质溶液的肼--空气燃料电池,放电时的负极反应式:N2H4-4e-+4OH-=N2+4H2O | |
| D. | 铂做电极,以KOH溶液为电解质溶液的肼--空气燃料电池,工作一段时间后,KOH溶液的pH将增大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com