
下列有关说法正确的是 ( )
| A.反应:2CO(g) +2NO(g) |
B.0.1mol·L-1'Na2 CO3溶液加蒸馏水稀释,CO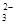 '的水解程度变大,溶液的pH不断增大 '的水解程度变大,溶液的pH不断增大 |
| C.电解精炼铜过程中,阳极质量的减少量与阴极质量的增加量一定相等 |
D.C(s) +CO2(g) 2CO(g)△H>0,其他条件不变时升高温度,反应速率v(CO2)和CO2的平衡转化率均增大 2CO(g)△H>0,其他条件不变时升高温度,反应速率v(CO2)和CO2的平衡转化率均增大 |
科目:高中化学 来源: 题型:单选题
一定条件下,在2L密闭容器中加入某A气体8.0mol,在4s时测得A气体的物质的量为5.6mol,则此4s内用A表示该反应速率正确的是: ( )
| A.0.3 mol·L-1s-1 | B.0.6 mol·L-1s-1 |
| C.1.0 mol·L-1s-1 | D.0.7 mol·L-1s-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
在密闭容器中通入物质的量浓度均0.1mol·L-1的CH4与CO2,在一定条件下发生反应: ,测得CH4的平衡转化率与温度及压强的关系如图5,下列有关说法一定正确的是
,测得CH4的平衡转化率与温度及压强的关系如图5,下列有关说法一定正确的是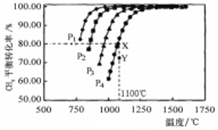
| A.上述反应的△H>0 |
| B.压强P1>P2>P3>P4 |
| C.1100℃该反应的平衡常数为64mol2·L-1 |
| D.压强为P4时,在Y点:v(正)<v(逆) |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
T℃时,将气体X与气体Y置于一密闭容器中,反应生成气体Z,反应过程中各物质的浓度变化如图(Ⅰ)所示。保持其它条件不变,在T1、T2两种温度下,Y的体积分数变化如图(Ⅱ)所示,下列结论正确的是( )
| A.图(Ⅱ)中T1>T2,则正反应是吸热反应 |
| B.t2 min时,保持压强不变,通入稀有气体,平衡向正反应方向移动 |
| C.其它条件不变,升高温度,正、逆反应速率均增大,且X的转化率增大 |
| D.T℃时,若密闭容器中各物质起始浓度为:0.4 mol·L-1X、0.4 mol·L-1 Y、0.2mol/LZ保持其他 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列说法正确的是
| A.常温下,中和pH与体积均相同的盐酸和醋酸消耗NaOH的物质的量相同 |
| B.纯铁和生铁在酸雨中均发生电化学腐蚀 |
| C.使用催化剂不但能加快反应速率,而且可以让不可能发生的反应发生 |
| D.食品工业用NaHCO3作焙制糕点的膨松剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列有关说法正确的是
| A.锌与稀硫酸反应时加入少量硫酸铜,反应加快的原因是Cu2+水解增大了H+浓度 |
| B.增大醋酸溶液的浓度,溶液中c(OH-)减小的原因是水的离子积Kw减小 |
| C.pH=3的盐酸与pH=11的LiOH溶液等体积混合溶液呈碱性,说明LiOH为强碱 |
| D.TATP(C8H18O6)受撞击分解爆炸,且无明显热效应,说明该分解反应熵显著增加 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
一定温度下,在密闭容器内有如下化学反应平衡:CO+H2O(g)  H2+CO2。向容器内加入1molCO和1mol H2O(g)时,生成2/3mol CO2如果通入的H2O(g)改为4mol时,在上述条件下,生成CO2的物质的量为
H2+CO2。向容器内加入1molCO和1mol H2O(g)时,生成2/3mol CO2如果通入的H2O(g)改为4mol时,在上述条件下,生成CO2的物质的量为
| A.0.5mol | B.0.6mol | C.0.9mol | D.2.5mol |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
反应I2+I- I3-达到平衡时c(I3-)与温度的关系如图所示。
I3-达到平衡时c(I3-)与温度的关系如图所示。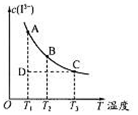
下列说法正确的是
| A.图中反应进行到状态D时,一定有v逆>v正 |
| B.A点和B点的化学平衡常数相同 |
| C.对B点溶液升高温度时,该反应△v正>△v逆 |
| D.增大KI溶液浓度有利于I2的溶解 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
对于可逆反应2SO2+O2 2SO3,在混合气体中充入一定量的18O2,足够长的时间后,18O原子( )
2SO3,在混合气体中充入一定量的18O2,足够长的时间后,18O原子( )
| A.只存在于O2中 | B.只存在于O2和SO3中 |
| C.只存在于O2和SO2中 | D.存在于O2、SO2和SO3中 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com