
分析 滴加氨水的过程中,氨水电离产生的OH-对水的电离平衡起抑制作用;根据电荷守恒,求溶液中铵根离子的物质的量.
解答 解:向(NH4)2SO4溶液中滴加稀氨水的过程中水的电离平衡受到抑制,H2O?H++OH-,加入酸和碱平衡逆向移动,因此加氨水对水的电离起逆向移动;由amol(NH4)2SO4溶于水,向该溶液中滴加VL稀氨水后溶液呈中性可知,c(OH-)=10-7mol/L,
设平衡时NH3•H2O的物质的量为x,溶液的体积为b,
则:NH3•H2O?NH4++OH-
x/b 2a/b 10-7
由电离平衡常数可知:$\frac{\frac{2a}{b}×1{0}^{-7}}{\frac{x}{b}}$=2×10-5,解之得:x=$\frac{a}{100}$,则c(NH3•H2O)=$\frac{a}{100V}$mol/L,
故答案为:逆向;$\frac{a}{100V}$.
点评 本题考查影响水的电离平衡移动的因素、电离平衡常数的计算,但难度不大.


科目:高中化学 来源: 题型:填空题
| ⅠA | ⅧA | |||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ④ | ⑧ | ||||
| 3 | ⑤ | ⑥ | ⑦ | ⑨ | ||||
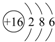 .
.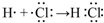 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素 | 结构、性质等信息 |
| X | 构成有机物的核心元素,该元素的一种氧化物和气态氢化物都是典型的温室气体 |
| Y | 短周期中(除稀有气体外)原子半径最大的元素,该单质液态时可用作核反应堆的传热介质 |
| Z | 与Y同周期,其最高价氧化物的水化物呈两性 |
| M | 海水中除氢、氧元素外含量最多的元素,其单质或化合物也是自来水生产过程中常用的消毒杀菌剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 当10NA个电子转移时,该反应放出1 300 kJ的能量 | |
| B. | 当1NA个水分子生成且为液体时,吸收1300 kJ的能量 | |
| C. | 当2NA个碳氧共用电子对生成时,放出1300 kJ的能量 | |
| D. | 当4NA个碳氧共用电子对生成时,放出1300 kJ的能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  | B. |  | C. |  | D. |  |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

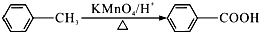
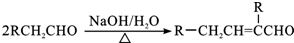
 .
. .
. 或
或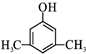 (写出其中一种的结构简式).
(写出其中一种的结构简式).查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com