
| A. | 在常温下氮气比氧气和氯气稳定 | |
| B. | 氮、氧和氯的单质常温下为气体 | |
| C. | 氮、氧和氯分子在反应过程中释放能量 | |
| D. | 氮气、氧气和氯气的密度不同 |
科目:高中化学 来源: 题型:选择题
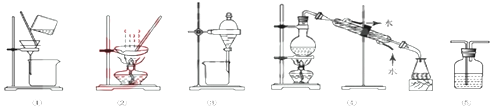
| A. | 分离Na2CO3溶液和CH3COOC2H5,选④ | B. | 粗盐提纯,选①和② | ||
| C. | 用FeC12溶液吸收C12,选⑤ | D. | 用CC14提取碘水中的碘,选③ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
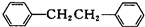 )是一种重要的有机合成中间体,实验室可用苯和1,2一二氯乙烷(ClCH2CH2Cl)为原料,在无水AlCl3催化下加热制得,其制取步骤为:
)是一种重要的有机合成中间体,实验室可用苯和1,2一二氯乙烷(ClCH2CH2Cl)为原料,在无水AlCl3催化下加热制得,其制取步骤为: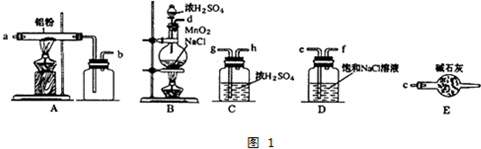

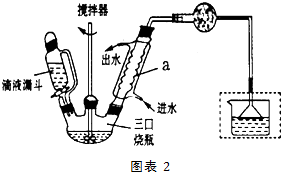
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 在苹果、香蕉等水果的果香中存在着乙酸正丁酯.某化学课外兴趣小组欲以乙酸和正丁醇为原料合成乙酸正丁酯.实验步骤如下:
在苹果、香蕉等水果的果香中存在着乙酸正丁酯.某化学课外兴趣小组欲以乙酸和正丁醇为原料合成乙酸正丁酯.实验步骤如下:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
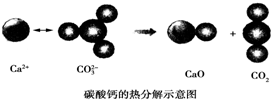
| A. | CO2(g)和CaO(s)的总能量大于CaCO3(s)的总能量 | |
| B. | 由该反应可推出凡是需要加热才发生的反应均为吸热反应 | |
| C. | 该反应的焓变大于零 | |
| D. | 该反应中有离子键断裂也有共价键断裂,化学键断裂吸收能量,化学键生成放出能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电池工作时锌为负极 | |
| B. | 电池正极的电极反应式为:2MnO2+2H2O+2e-═2MnOOH+2OH- | |
| C. | 电池工作时,电解液的OH-移向正极 | |
| D. | 外电路中每通过0.2mol电子,锌的质量理论上减少6.5g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 整个反应阶段平均速率:醋酸>盐酸 | B. | 反应所需时间:醋酸>盐酸 | ||
| C. | 参加反应的锌质量:盐酸>醋酸 | D. | 开始,反应速率:盐酸>醋酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com