
下表是短周期中部分元素的原子半径及主要化合价。
| 元素代号 | U | V | W | X | Y | Z |
| 原子半径/nm | 0.037 | 0.157 | 0.066 | 0.070 | 0.077 | 0.143 |
| 主要化合价 | +1 | +1 | -2 | -3 +5 | +2 +4 | +3 |
请回答:
(1)X在元素周期表中的位置是 第二周期ⅤA族 。
(2)V、W、Z三种元素的离子具有相同的电子层结构,三者的离子半径由大到小顺序是O2->Na+>Al3+ (用离子符号表示)。用离子方程式表示出Z离子可作净水剂的原因:________________________________________________________________________
________________________________________________________________________。
(3)某些元素可形成既含离子键又含共价键的化合物,写出其中一种化合物的电子式: Na+[
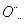
 H]- 。2·1·c·n·j·y
H]- 。2·1·c·n·j·y
(4)1 g YU4气体完全燃烧生成液态水时,放出a kJ的热量,则该反应的热化学方程式为________________________________________________________________________
________________________________________________________________________。
(5)现有Z与V2W2的固体混合物样品,加入稀盐酸至混合物完全溶解,所得的混合液中c(Z3+)∶c(H+)∶c(Cl-)=1∶2∶8,则原固体混合物中,Z元素与W元素的质量比为 9∶16 (最简整数比)。【来源:21·世纪·教育·网】
(1)第二周期ⅤA族 (2)O2->Na+>Al3+ Al3++3H2OAl(OH)3(胶体)+3H+ (3)Na+[
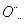
 H]- (4)CH4(g)+2O2(g)===CO2(g)+2H2O(l) ΔH=-16a kJ/mol (5)9∶16
H]- (4)CH4(g)+2O2(g)===CO2(g)+2H2O(l) ΔH=-16a kJ/mol (5)9∶16
解析:本题考查元素周期律、元素推断和反应热等知识。根据元素周期律,将元素按化合价先确定所在的主族,再按照原子半径规律确定位置关系,即可知U、V、W、X、Y、Z六种元素分别为氢、钠、氧、氮、碳、铝。(5)根据电荷守恒,溶液中AlCl3、HCl、NaCl三者的物质的量之比为1∶2∶3,则固体混合物中Al和Na2O2的物质的量之比为2∶3,Al元素与O元素的质量比为9∶16。


 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案科目:高中化学 来源: 题型:
下列关于有机物的叙述,正确的是( )
A.加浓溴水,然后过滤,可除去苯中混有的少量乙烯
B.苯、溴水和铁粉混合可制成溴苯
C.氨基酸、淀粉均属于高分子化合物
D.已知甲苯苯环上的二氯取代物有6种,则甲苯苯环上的三氯取代物也有6种
查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y、Z是原子序数依次递增的短周期元素,3种元素的原子核外电子数之和与Ca2+的核外电子数相等,X、Z分别得到1个电子后均形成稀有气体原子的稳定电子层结构。下列说法正确的是( )
A.原子半径:Z>Y>X
B.Z与X形成化合物的沸点高于Z的同族元素与X形成化合物的沸点
C.Na2Y2与水发生氧化还原反应时,Na2Y2只作氧化剂
D.CaX2、CaY2和CaZ2等3种化合物中,阳离子与阴离子个数比均为1∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
短周期元素W、X、Y、Z的原子序数依次增大,其中W的阴离子的核外电子数与X、Y、Z原子的核外内层电子数相同。X的一种核素在考古时常用来鉴定一些文物的年代,工业上采用液态空气分馏方法来生产Y的单质,而Z不能形成双原子分子。根据以上叙述,下列说法中正确的是( )21世纪教育网版权所有
A.上述四种元素的原子半径大小为W<X<Y<Z
B.W、X、Y、Z原子的核外最外层电子数的总和为20
C.W与Y可形成既含极性共价键又含非极性共价键的化合物
D.由W与X组成的化合物的沸点总低于由W与Y组成的化合物的沸点
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法不正确的是
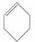 A.
A. 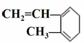 与Br2发生1:1加成反应的产物有5种
与Br2发生1:1加成反应的产物有5种
B.除去苯中 的方法:加溴水,充分振荡,静置分液。
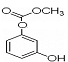 |
C. 1mol 最多能与4mol氢氧化钠反应。
D.采用分子筛固体酸作为苯和丙烯反应的催化剂来制备异丙苯,符合绿色化学工艺。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com