

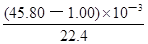 ;解①②可得:x=0.001,y=0.001,则合金中铁的质量为0.056g,镁为0.024g,所以合金中铁的质量分数为
;解①②可得:x=0.001,y=0.001,则合金中铁的质量为0.056g,镁为0.024g,所以合金中铁的质量分数为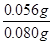 ×100%=70%。
×100%=70%。

科目:高中化学 来源:不详 题型:实验题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
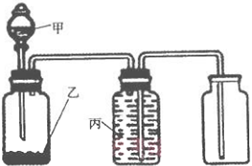
| 选项 | 甲 | 乙 | 丙 | 实验目的 |
| A | 浓氨水 | NaOH | 饱和食盐水 | 制取并收集氨气 |
| B | 浓盐酸 | MnO2 | 饱和食盐水 | 制取并收集氯气 |
| C | 稀硝酸 | Cu | 水 | 制取并收集一氧化氮 |
| D | 稀硝酸 | Zn | 水 | 制取并收集氢气 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
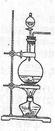

查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
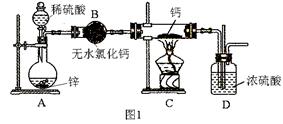
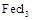 易升华。工业上制备无水的
易升华。工业上制备无水的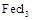 的一种工艺如图所示:
的一种工艺如图所示: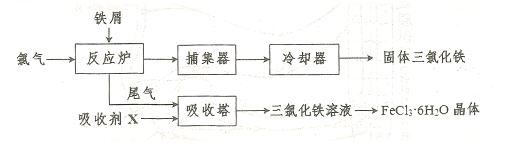
 Fe2++Cr3+,则电池放电时,Cl-将移向 极(填“正”或“负”);充电时,阴极的电极反应式为 。
Fe2++Cr3+,则电池放电时,Cl-将移向 极(填“正”或“负”);充电时,阴极的电极反应式为 。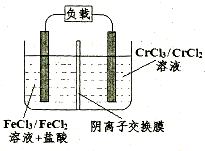
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
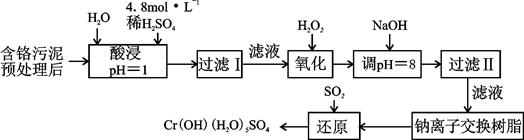
| 阳离子 | Fe3+ | Fe2+ | Mg2+ | Al3+ | Cu2+ | Cr3+ |
| 开始沉淀时的pH | 1.9 | 7.0 | —— | —— | 4.7 | —— |
| 沉淀完全时的pH | 3.2 | 9.0 | 11.1 | 8 | 6.7 | 9 (>9溶解) |
 Cr3+(aq)+3OH-(aq)
Cr3+(aq)+3OH-(aq) 的溶度积Ksp= c(Cr3+)? c3(OH-)=10-32,要使c(Cr3+)降至10-5mol/L,溶液的pH应调至 。
的溶度积Ksp= c(Cr3+)? c3(OH-)=10-32,要使c(Cr3+)降至10-5mol/L,溶液的pH应调至 。查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
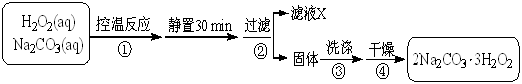
 2Na2CO3·3H2O2 (s) ΔH < 0
2Na2CO3·3H2O2 (s) ΔH < 0
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题



查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
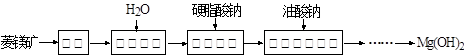
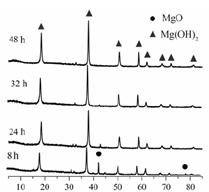
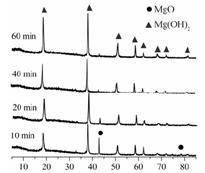


| LiOH | NaOH | KOH | Al(OH)3 | Mg(OH)2 | Ca(OH)2 | Ba(OH)2 |
| 924 | 不分解 | 不分解 | 140 | 258 | 390 | 700 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com