
| »Æѧ¼ü | S=O£ØSO2£© | S=O£ØSO3£© | O=O£ØO2£© |
| ÄÜĮæ/kJ | 535 | 472 | 496 |
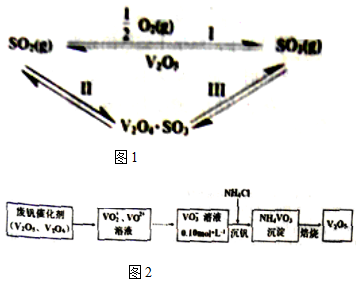
·ÖĪö £Ø1£©·“Ó¦IµÄČČ»Æѧ·“Ó¦·½³ĢŹ½ĪŖSO2£Øg£©+$\frac{1}{2}$O2£Øg£©=SO3£Øg£©”÷H£¬·“Ó¦ČȵČÓŚ·“Ó¦ĪļµÄ×ܼüÄܼõÉś³ÉĪļµÄ×ܼüÄÜ£»
V2O5ŌŚ·“Ó¦ÖŠ×÷“߻ƼĮ£¬·“Ó¦¢ņÉś³ÉV2O4•SO3£¬V2O5²Ī¼Ó·“Ó¦£¬·“Ó¦¢óŹĒV2O4•SO3ÓėŃõĘų·“Ӧɜ³ÉV2O5ŗĶSO3£»
£Ø2£©¢ŁĖ®½āÉś³ÉVO2+£¬VµÄ»ÆŗĻ¼ŪĪŖ+4¼Ū£¬æÉÓÉV4+Ė®½āÉś³É£»
¢ŚČÜŅŗÖŠc£ØVO3-£©=0.1mol/L£¬ĪŖŹ¹·°ŌŖĖŲµÄ³ĮµķĀŹ“ļµ½98%£¬Ōņ³Įµķŗóc£ØVO3-£©=0.002mol/L£¬½įŗĻKsp£ØNH4VO3£©=1.6”Į10-3¼ĘĖć£»
£Ø3£©¢ŁŌŚ£ØNH4£©2SO4ČÜŅŗÖŠ“ęŌŚĖ®½ā·“Ó¦£¬NH4++H2O?NH3•H2O+H+£¬Ķł£ØNH4£©2SO4ČÜŅŗÖŠŌŁ¼ÓČėÉŁĮæ £ØNH4£©2SO4¹ĢĢ壬Ė®½āĘ½ŗāĻņÕż·½Ļņ½ųŠŠ£¬µ«ļ§øłµÄĖ®½āĀŹ¼õŠ”£»
¢Śøł¾ŻĖ®½āĘ½ŗā³£ŹżKh=$\frac{c£ØN{H}_{3}•{H}_{2}O£©•c£Ø{H}^{+}£©}{c£ØN{{H}_{4}}^{+}£©}$=$\frac{c£ØN{H}_{3}•{H}_{2}O£©•c£Ø{H}^{+}£©}{c£ØN{{H}_{4}}^{+}£©}$•$\frac{c£ØO{H}^{-}£©}{c£ØO{H}^{-}£©}$=$\frac{{K}_{w}}{{K}_{b}}$¼ĘĖć£®
½ā“š ½ā£ŗ£Ø1£©·“Ó¦ČȵČÓŚ·“Ó¦ĪļµÄ×ܼüÄܼõÉś³ÉĪļµÄ×ܼüÄÜ£¬·“Ó¦IµÄČČ»Æѧ·“Ó¦·½³ĢŹ½ĪŖSO2£Øg£©+$\frac{1}{2}$O2£Øg£©=SO3£Øg£©”÷H£¬Ōņ·“Ó¦IµÄ”÷H=£Ø2”Į535+$\frac{1}{2}$”Į496-3”Į472£©kJ/mol=-98kJ/mol£»V2O5ŌŚ·“Ó¦ÖŠ×÷“߻ƼĮ£¬·“Ó¦¢ņÉś³ÉV2O4•SO3£¬V2O5²Ī¼Ó·“Ó¦£¬·½³ĢŹ½ĪŖSO2+V2O5?V2O4•SO3£¬·“Ó¦¢óŹĒV2O4•SO3ÓėŃõĘų·“Ӧɜ³ÉV2O5ŗĶSO3·“Ó¦¢ņÉś³ÉV2O4•SO3£¬·½³ĢŹ½ĪŖ2V2O4•SO3+O2?2V2O5+2SO3£¬
¹Ź“š°øĪŖ£ŗ-98£»2V2O4•SO3+O2?2V2O5+2SO3£»
£Ø2£©¢ŁĖ®½āÉś³ÉVO2+£¬VµÄ»ÆŗĻ¼ŪĪŖ+4¼Ū£¬æÉÓÉV5+Ė®½āÉś³É£¬·½³ĢŹ½ĪŖV4++H2O=VO2++2H+£¬
¹Ź“š°øĪŖ£ŗV4++H2O=VO2++2H+£»
¢ŚČÜŅŗÖŠc£ØVO3-£©=0.1mol/L£¬ĪŖŹ¹·°ŌŖĖŲµÄ³ĮµķĀŹ“ļµ½98%£¬Ōņ³Įµķŗóc£ØVO3-£©=0.002mol/L£¬ÓÉKsp£ØNH4VO3£©=1.6”Į10-3æÉÖŖc£ØNH4+£©=$\frac{1.6”Į1{0}^{-3}}{0.002}$mol/L=0.8mol/L£¬
¹Ź“š°øĪŖ£ŗ0.8mol/L£»
£Ø3£©¢ŁŌŚ£ØNH4£©2SO4ČÜŅŗÖŠ“ęŌŚĖ®½ā·“Ó¦£¬NH4++H2O?NH3•H2O+H+£¬Ķł£ØNH4£©2SO4ČÜŅŗÖŠŌŁ¼ÓČėÉŁĮæ £ØNH4£©2SO4¹ĢĢ壬Ė®½āĘ½ŗāĻņÕż·½Ļņ½ųŠŠ£¬µ«ļ§øłµÄĖ®½āĀŹ¼õŠ”£¬ĖłŅŌ$\frac{c£ØN{{H}_{4}}^{+}£©}{c£ØS{{O}_{4}}^{2-}£©}$µÄÖµ½«±ä“ó£¬
¹Ź“š°øĪŖ£ŗ±ä“ó£»
¢ŚĖ®½āĘ½ŗā³£ŹżKh=$\frac{c£ØN{H}_{3}•{H}_{2}O£©•c£Ø{H}^{+}£©}{c£ØN{{H}_{4}}^{+}£©}$=$\frac{c£ØN{H}_{3}•{H}_{2}O£©•c£Ø{H}^{+}£©}{c£ØN{{H}_{4}}^{+}£©}$•$\frac{c£ØO{H}^{-}£©}{c£ØO{H}^{-}£©}$=$\frac{{K}_{w}}{{K}_{b}}$£¬pH=a£¬c£ØH+£©=1”Į10-a£¬
Ōņ$\frac{c£ØN{{H}_{4}}^{+}£©}{c£ØN{H}_{3}•{H}_{2}O£©}$=$\frac{c£Ø{H}^{+}£©}{{K}_{h}}$=$\frac{c£Ø{H}^{+}£©•{K}_{b}}{{K}_{w}}$=10-a”Į$\frac{1.7”Į1{0}^{-5}}{1”Į1{0}^{-14}}$=1.7”Į10£Ø9-a£©£¬
¹Ź“š°øĪŖ£ŗ1.7”Į10£Ø9-a£©£®
µćĘĄ ±¾Ģā漲鷓ӦČČÓėģŹ±äµÄ¼ĘĖćŅŌ¼°ŃĪĄąĖ®½āµÄÓ¦ÓĆ£¬ŅŖĒóѧɜ¶Ō»ł“”ÖŖŹ¶µÄÕĘĪÕŌśŹµ£¬²ąÖŲӌѧɜµÄ·ÖĪö”¢¼ĘĖćÄÜĮ¦µÄ漲飬עŅā°ŃĪÕĢāÖŠĖłøųŠÅĻ¢£¬ÄŃ¶Č½Ļ“ó£®


 ŌĶĮæģ³µĻµĮŠ“š°ø
ŌĶĮæģ³µĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ÉÕ± | B£® | Ģś¼ÜĢأؓųĢśČ¦£© | C£® | Ā©¶· | D£® | Ņ©³× |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
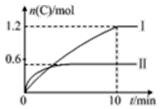 ŌŚ2LµÄŗćČŻĆܱÕČŻĘ÷ÖŠ³äČėA£Øg£©ŗĶB£Øg£©£¬·¢Éś·“Ó¦A£Øg£©+B£Øg£©?2C£Øg£©+D£Øs£©”÷H=a kJ•mol-1£¬ŹµŃéÄŚČŻŗĶ½į¹ū·Ö±šČē±ķŗĶĶ¼ĖłŹ¾£¬ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ£Ø””””£©
ŌŚ2LµÄŗćČŻĆܱÕČŻĘ÷ÖŠ³äČėA£Øg£©ŗĶB£Øg£©£¬·¢Éś·“Ó¦A£Øg£©+B£Øg£©?2C£Øg£©+D£Øs£©”÷H=a kJ•mol-1£¬ŹµŃéÄŚČŻŗĶ½į¹ū·Ö±šČē±ķŗĶĶ¼ĖłŹ¾£¬ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ£Ø””””£©| ŹµŃé ŠņŗÅ | ĪĀ¶Č | ĘšŹ¼ĪļÖŹµÄĮæ | ČČĮæ ±ä»Æ | |
| A | B | |||
| ¢ń | 600”ę | 1 mol | 3 mol | 96 kJ |
| ¢ņ | 800”ę | 1.5 mol | 0.5 mol | -- |
| A£® | ÉĻŹö·½³ĢŹ½ÖŠa=-160 | |
| B£® | ŹµŃé¢ńÖŠ£¬10 minÄŚĘ½¾łĖŁĀŹv£ØB£©=0.06 mol•L-1•min-1 | |
| C£® | 600”ꏱ£¬øĆ·“Ó¦µÄĘ½ŗā³£ŹżŹĒ0.45 | |
| D£® | ĻņŹµŃé¢ņµÄĘ½ŗāĢåĻµÖŠŌŁ³äČė0.5 mol AŗĶ1.5 mol B£¬AµÄ×Ŗ»ÆĀŹ¼õŠ” |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | °×É«¹ĢĢåŅ»¶ØÖ»ŗ¬ÓŠĮņĖįļ§ | |
| B£® | ČōĒāŃõ»ÆÄĘČÜŅŗ×ćĮ棬ŌņÉś³É°±ĘųµÄĢå»żÓ¦ĪŖ6.72L£Ø±źæö£© | |
| C£® | “ÓÉĻŹöŹż¾ŻÄÜĒóĖć³ö°×É«¹ĢĢåÖŠ£ØNH4£©2SO4”¢NH4HSO4µÄĪļÖŹµÄĮæÖ®±ČĪŖ1£ŗ2 | |
| D£® | ½«Ä³°×É«¹ĢĢå¼ÓČČ·Ö½ā£¬Čō²śÉśµÄĘųĢå²»ÄÜŹ¹ŹŖČóµÄŗģÉ«ŹÆČļŹŌÖ½±äĄ¶£¬ŌņøĆ¹ĢĢåÖŠŅ»¶Ø²»ŗ¬ļ§ŃĪ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | 1molōĒ»łÓė1molĒāŃõøłĄė×ÓĖłŗ¬ÓŠµÄµē×ÓŹżÄæ¾łĪŖ9NA | |
| B£® | µē½ā±„ŗĶŹ³ŃĪĖ®£¬µ±Ņõ¼«²śÉś2.24LĘųĢåŹ±£¬×ŖŅʵĵē×ÓŹżĪŖ0.2NA | |
| C£® | 7.8gNa2O2ŗĶNa2SµÄ»ģŗĻĪļÖŠŗ¬ÓŠµÄĄė×Ó×ÜŹżĪŖ0.7NA | |
| D£® | ³£ĪĀĻĀ£¬1L0.1mol/LNa2CO3ČÜŅŗÖŠ£¬ŗ¬ÓŠĄė×ÓµÄ×ÜŹż“óÓŚ0.3NA |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
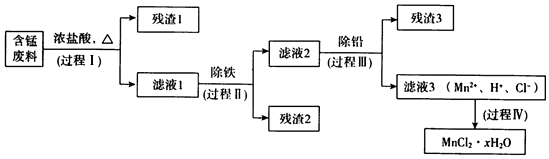
| Mn£ØOH£©2 | Pb£ØOH£©2 | Fe£ØOH£©3 | |
| æŖŹ¼³ĮµķŹ± | 8.1 | 6.5 | 1.9 |
| ĶźČ«³ĮµķŹ± | 10.1 | 8.5 | 3.2 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
 ¶ž¼×ĆŃŹĒŅ»ÖÖÖŲŅŖµÄĒå½ąČ¼ĮĻ£¬Ņ²æÉĢę“ś·śĄū°ŗ×÷ÖĘĄä¼ĮµČ£¬¶Ō³ōŃõ²ćĪŽĘĘ»µ×÷ÓĆ£®¹¤ŅµÉĻæÉĄūÓĆĆŗµÄĘų»Æ²śĪļ£ØĖ®ĆŗĘų£©ŗĻ³É¶ž¼×ĆŃ£®
¶ž¼×ĆŃŹĒŅ»ÖÖÖŲŅŖµÄĒå½ąČ¼ĮĻ£¬Ņ²æÉĢę“ś·śĄū°ŗ×÷ÖĘĄä¼ĮµČ£¬¶Ō³ōŃõ²ćĪŽĘĘ»µ×÷ÓĆ£®¹¤ŅµÉĻæÉĄūÓĆĆŗµÄĘų»Æ²śĪļ£ØĖ®ĆŗĘų£©ŗĻ³É¶ž¼×ĆŃ£®²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com